Властивість граничних карбонових кислот
Карбонові кислоти містять карбоксильну угруповання -COOH. Властивості кислоти визначаються природою радикала R, зазвичай це слабкі кислоти, pH = 4-5. Назва походить від відповідного вуглеводню з додаванням закінчення «-вая кислота» або закінчення «-карбоновая кислота» до вуглеводню на один атом менше:
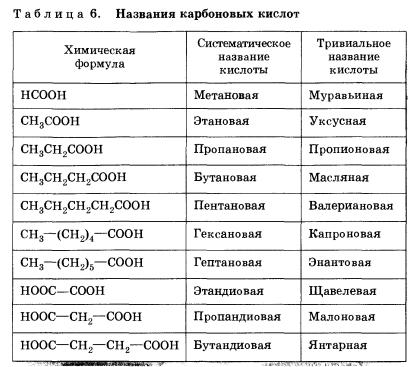
R = H - метанова кислота, мурашина кислота;
R = CH 3 - метанова кислота, метанкарбоновая кислота, оцтова кислота;
R = C 2H 5 - пропановая кислота, етанкарбоновая кислота, пропіонова кислота;
R = C 6H 5 - бензойна кислота, феніл карбонова кислота;
R = (C 6H 5) 3C - трифенил оцтова кислота.
1. Дисоціація з утворенням катіонів водню і аніонів кислотного залишку. Більш точно цей процес описує рівняння, що враховує участь в ньому молекул води.
Рівновага дисоціації карбонових кислот зміщене вліво, переважна більшість їх - слабкі електроліти. Очевидно, що присутністю в молекулах карбонових кислот «кислого» водню, т. Е. Водню карбоксильної групи, обумовлені і інші характерні властивості.
2. Взаємодія з металами. що стоять в електрохімічному ряді напруг до водню. Так, залізо відновлює водень з оцтової кислоти:
2СН3-СООН + Fe -> (CHgCOO) 2Fe + Н2
3. Взаємодія з основними оксидами з утворенням солі і води:
2R-СООН + СаО -> (R-СОО) 2Са + Н20
4. Взаємодія з гідроксидами металів з утворенням солі і води (реакція нейтралізації):
R-СООН + NaOH -> R-COONa + Н20 3R-СООН + Са (ОН) 2 -> (R-СОО) 2Са + 2Н20
5. Взаємодія з солями слабших кислот. з утворенням останніх. Так, оцтова кислота витісняє стеаринову з стеарат натрію і вугільну з карбонату калію.
6. Взаємодія карбонових кислот зі спиртами з утворенням складних ефірів - вже відома вам реакція ете-ріфікаціі (одна з найбільш важливих реакцій, характерних для карбонових кислот). Взаємодія карбонових кислот зі спиртами каталізується катіонами водню.
Реакція етерифікації оборотна. Рівновага зміщується в бік утворення складного ефіру в присутності водоотні-мающих засобів і видаленні ефіру з реакційної суміші.
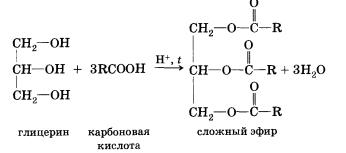
В реакції, зворотної етерифікації, яка називається гідролізом складного ефіру (взаємодія складного ефіру з водою), утворюються кислота і спирт. Очевидно, що реагувати з карбоновими кислотами, т. Е. Вступати в реакцію етерифікації, можуть і багатоатомні спирти, наприклад гліцерин:
DСЕ карбонові кислоти (крім мурашиної) поряд з карбоксильною групою містять в молекулах вуглеводневий залишок. Безумовно, це не може не позначитися на властивостях кислот, які визначаються характером вуглеводневої залишку.
7. Реакції приєднання по кратному зв'язку - в них вступають ненасичені карбонові кислоти; наприклад, реакція приєднання водню -гідрірованіе. При гідруванні олеїнової кислоти утворюється гранична стеаринова кислота.
Ненасичені карбонові кислоти, як і інші ненасичені сполуки, приєднують галогени за подвійним зв'язком. Так, наприклад, акрилова кислота знебарвлює бромную воду.
8. Реакції заміщення (з галогенами) - в неї здатні вступати граничні карбонові кислоти; наприклад, при взаємодії оцтової кислоти з хлором можуть бути отримані різні хлорпохідні кислоти:
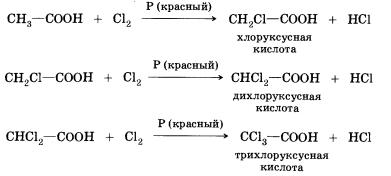
При Галогенування карбонових кислот, що містять більше одного атома вуглецю в вуглеводневому залишку, можливе утворення продуктів з різним становищем галогену в молекулі. При протіканні реакції по свободнорадикальному механізму можуть заміщатися будь атоми водню в вуглеводневому залишку. Якщо ж реакцію проводити в присутності невеликих кількостей червоного фосфору, то вона йде селективно - водень заміщається лише в а-положенні (у найближчого до функціональної групі атома вуглецю) в молекулі кислоти. Причини такої селективності ви дізнаєтеся при вивченні хімії в вищому навчальному закладі.
Карбонові кислоти утворюють різні функціональні похідні при заміщенні гідроксильної групи. При гідролізі цих похідних з них знову утворюється карбонова кислота.
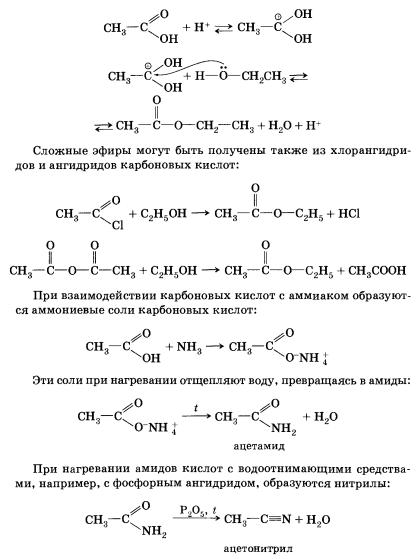
Хлорангідрид карбонової кислоти можна отримати дією на кислоту хлориду фосфору (ІІІ) або тіонілхлориду (SОСl2). Ангідриди карбонових кислот отримують взаємодією хлор-ангідридів з солями карбонових кислот. Складні ефіри утворюються в результаті етерифікації карбонових кислот спиртами. Етерифікація каталізується неорганічними кислотами.
Цю реакцію ініціює протонирование карбоксильної групи - взаємодія катіона водню (протона) з неподіленої електронної парою атома кисню. Протонирование карбоксильної групи тягне за собою збільшення позитивного заряду на атомі вуглецю в ній:
Якщо число атомів вуглецю в ланцюзі не перевищує п'яти, то це різко пахнуть, рухливі і летючі рідини. Вище п'яти - важкі маслянисті речовини, ще більше - тверді, парафінообразние.
Щільність перших двох представників перевищує одиницю. Всі інші легші за воду.
Температура кипіння: чим більше ланцюг, тим вище показник. Чим більше розгалужена структура, тим нижче.
Температура плавлення: залежить від парності кількості атомів вуглецю в ланцюзі. У парних вона вище, у непарних нижче.
У воді розчиняються дуже добре.
Здатні утворювати міцні водневі зв'язку