структура білка
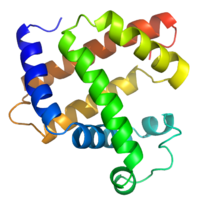
Структура Білків - 3-х мірна структура міоглобіну з виділенням α-спіраль.
Молекули білків представляють собою лінійні полімери, що складаються з 20 основних амінокислот (які є мономерами) і, в деяких випадках, з модифікованих основних амінокислот (правда модифікації відбуваються вже після синтезу білка на рибосомі). Для позначення амінокислот в науковій літературі використовуються одно- або трьохбуквені скорочення.
Послідовність амінокислот у білку відповідає інформації, що міститься в гені даного білка. Ця інформація представлена у вигляді поcледовательності нуклеотидів, причому одній амінокислоті відповідає одна або кілька послідовностей з трьох нуклеотидів - так званих кодонів або кодонів. Те, яка амінокислота відповідає даному кодону в мРНК визначається генетичним кодом, який може дещо відрізнятися у різних організмів.
Кінці білка називають С- і N- кінцем (в залежності від того, яка з груп кінцевої амінокислоти вільна (не приймає участь в утворенні пептидного зв'язку): -COOH або -NH2. Відповідно). При синтезі білка на рибосомі, нові амінокислоти приєднуються до C-кінця. Білки довжиною від 2 до 100 амінокислотних залишків часто називають пептидами, при більшому ступені полімеризації - протеїнами, хоча етоделеніе вельми умовно.
Рівні структури білка
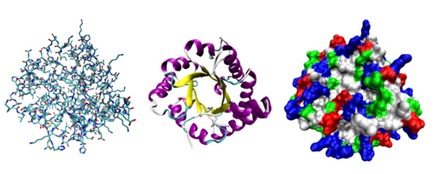
Крім послідовності (первинної структури), вкрай важлива тривимірна структура білка. Вона формується в процесі фолдинга (від англ. Folding, тобто згортання). Виділяють чотири рівні структури білка:
- послідовність амінокислотних залишків у поліпептидному ланцюзі.
Вторинна Структура Білка складається з асоціацій локальних фрагментів. Тут показані дві: бузковим виділена α спріль, жовтим β шари, і білим регіони без вторинної структури.
- локальне впорядковування фрагмента поліпептидного ланцюга, стабілізована водневими зв'язками і гідрофобними взаємодіями. Нижче наведені деякі поширені мотиви вторинної структури білків:
- просторова будова поліпептидного ланцюга - взаємне розташування елементів вторинної структури, стабілізовану взаємодією між бічними ланцюгами амінокислотних залишків. У стабілізації третинної структури беруть участь:
ковалентні зв'язки (між двома цистеїну - дисульфідні містки);
іонні (електростатичні) взаємодії (між протилежно зарядженими амінокислотними залишками);
- суб'едінічная структура білка. Взаємне розташування декількох поліпептидних ланцюгів у складі єдиного білкового комплексу.
Синтез білка і РНК
Інформаційна РНК, несуча відомості про первинну структуру білкових молекул, синтезується в ядрі. Пройшовши через пори ядерної оболонки, і-РНК направляється до рибосом, де здійснюється розшифровка генетичної інформації - переведення її з «мови» нуклеотидів на «мову» амінокислот. Амінокислоти, з яких синтезуються білки, доставляються до рибосом за допомогою спеціальних РНК, званих транспортними (т-РНК). У т-РНК послідовність трьох нуклеотидів комплементарна нуклеотидам кодону в і-РНК. Така послідовність нуклеотидів в структурі т-РНК називається антикодоном. Кожна т-РНК приєднує певну, «свою» амінокислоту, за допомогою ферментів і з витратою АТФ. У цьому полягає перший етап синтезу. Для того щоб амінокислота включилася в ланцюг білка, вона повинна відірватися від т-РНК. На другому етапі синтезу білка т-РНК виконує функцію перекладача з «мови» нуклеотидів на «мову» амінокислот. Такий переклад відбувається на рибосомі. У ній є дві ділянки: на одному т-РНК отримує команду від і-РНК - антикодон дізнається кодон, на іншому - виконується наказ - амінокислота відривається від т-РНК. Третій етап синтезу білка полягає в тому, що фермент синтетаза приєднує оторвавшуюся від т-РНК амінокислоту до зростаючої білкової молекулі. Інформаційна РНК безперервно ковзає по рибосоме, кожен триплет спочатку потрапляє в першу ділянку, де впізнається антикодоном т-РНК, потім на другу ділянку. Сюди ж переходить т-РНК з приєднаною до неї амінокислотою, тут амінокислоти відриваються від т-РНК і з'єднуються один з одним в тій послідовності, в якій триплети слідують один за іншим.