Розрахунок зміни енергії Гіббса хімічної реакції при стандартній температурі
Розрахунок змін енергії Гіббса хімічної реакції при стандартній температурі (298 К) може бути здійснений за наявності відповідних довідкових даних щодо змін стандартних потенціалів утворення речовин
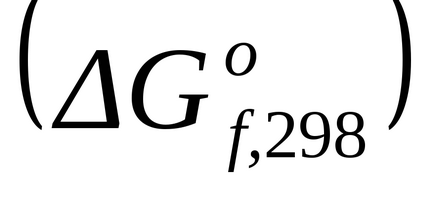
Стандартне зміна енергії Гіббса освіти простих стійких речовин дорівнює нулю.
Іншим методом розрахунку стандартного зміни енергії Гіббса хімічної реакції є застосування рівняння Гіббса-Гельмгольца:
де Т = 298 К;
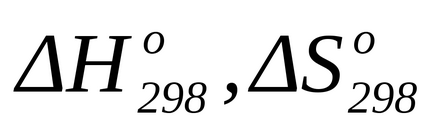
Розрахунок зміни енергії Гіббса хімічної реакції при нестандартної температурі
Розрахунок змін енергії Гіббса хімічної реакції при нестандартної температурі зазвичай виробляють за рівнянням Гіббса-Гельмгольца:
де Т - температура реакції;
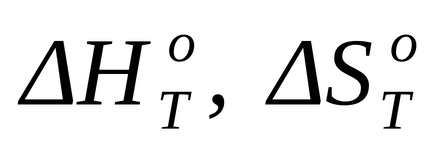
При наближених розрахунках можна використовувати допущення, що зміни ентальпії і ентропії не залежить від температури, і в розрахунках застосовувати їх стандартні значення, знайдені для температури 298 К:
де Т - температура реакції, для якої виконується наближений розрахунок.
При відсутності фазових переходів для точного розрахунку стандартного зміни енергії Гіббса при температурі Т (
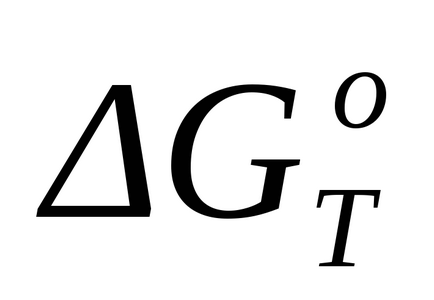
де Т - температура, при якій протікає реакція; Δa, Δb, Δc, Δc - коефіцієнти при Т в відповідних ступенях, отримані при розрахунку ΔСP; Mo, M1, M2, M2 - коефіцієнти при Δa, Δb, Δc, Δc відповідно, які для заданої температури наводяться в довідковій літературі для зазначеного методу розрахунку.
П р и м і р 1.15. Розрахувати наближено і точно зміна енергії Гіббса наступної хімічної реакції при Т = 298 К і Т = 1800 к і визначити можливість її протікання при даних температурах:
Необхідні довідкові дані представлені в табл. 1.10.
Знаходимо стандартний тепловий ефект у вигляді зміни ентальпії по відомим теплотам освіти за формулою (1.17):
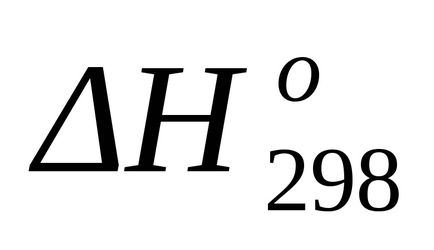
Стандартне зміна ентропії знаходимо за формулою (1.38):
Стандартне зміна енергії Гіббса при Т = 298 К знаходимо по
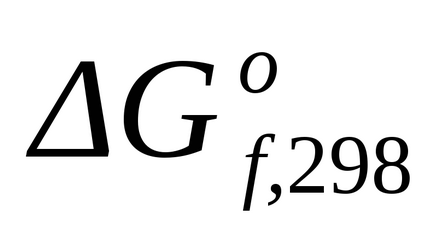
Стандартне зміна енергії Гіббса при Т = 298 К розрахуємо також за рівнянням (1.43):
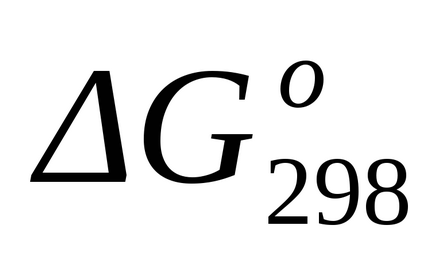
Стандартне зміна енергії Гіббса при Т = 1800 к знаходимо наближено за формулою (1.46):
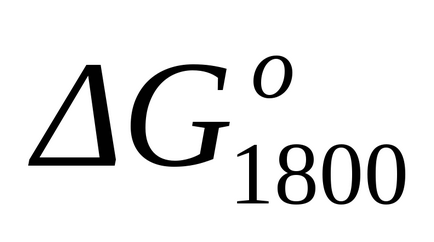
Так як при температурах 298 К і 1800 К
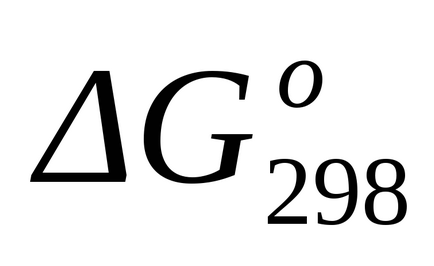
точний розрахунок
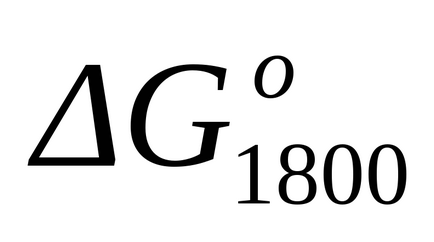
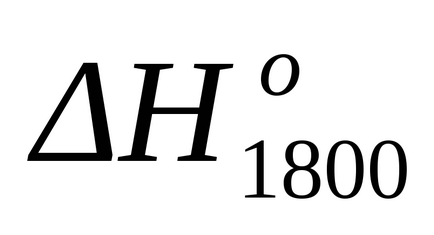
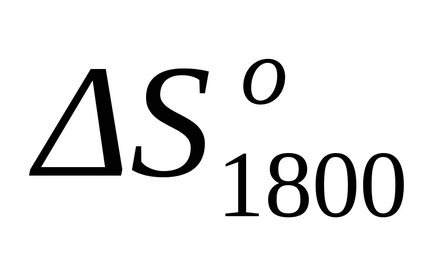
Δa = (25,02 + 2 · 30,00) - (62,86 + 2 · 27,28) = - 32,40;
Рівняння залежності зміни теплоємності від температури після підстановки в нього знайдених значень Δa, Δb, Δc матиме вигляд:
Після підстановки даного рівняння в формули (1.25) і (1.39) виробляємо розрахунок зміни ентальпії і зміни ентропії для даної реакції при Т = 1800:

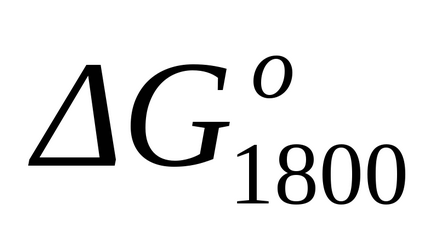
Так як знайдені значення зміни енергії Гіббса
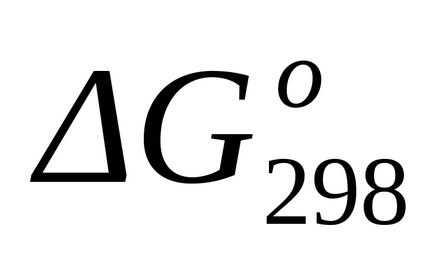
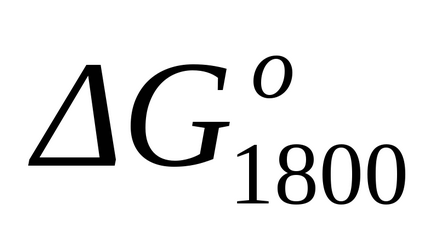
П р и м і р 1.16. Розрахувати зміна енергії Гіббса хімічної реакції прикладу 1.15 при Т = 1800 к по методу Тьомкіна-Шварцмана.
Розрахунок виконується за формулою (1.47) стосовно аналізованої реакції, в якій всі учасники є неорганічними речовинами:
Значення коефіцієнтів Мn беруться з довідника для заданої температури 1800 к:
величини
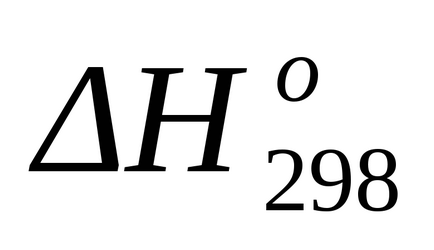
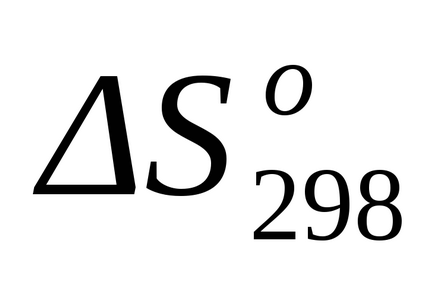
Знаходимо зміну енергії Гіббса реакції при Т = 1800 к: