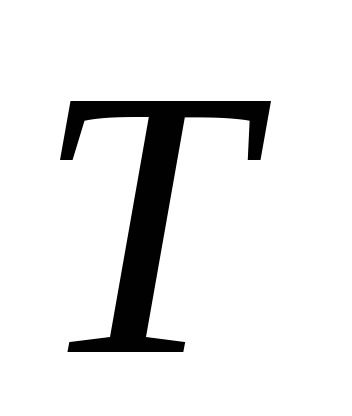Розділ 4 друге і третє початку термодинаміки
Ентропія (від греч.entropia- поворот, перетворення) - поняття, вперше введене втермодінаміке для визначення міри незворотного розсіювання енергії. Ентропія встатістіческой фізики - міра ймовірності здійснення будь-якого макроскопічного стану, втеоріі інформації - міра невизначеності будь-якого досвіду (випробування), який може мати різні наслідки. Ці трактування ентропії мають глибоку внутрішню зв'язок.
1 Ентропія. Термодинамічний сенс ентропії
По суті всі процеси в макросистемах є незворотними.
Виникає питання: у чому причина незворотності? Це виглядає особливо дивно, якщо врахувати, що всі закони механіки оборотні в часі. І тим не менше, ніхто не бачив, щоб, наприклад, розбилася ваза мимовільно відновилася з осколків.
Вирішення цієї складної проблеми прийшло з відкриттям нової термодинамічної величини - ентропії - і розкриттям її фізичного сенсу.
Поняття ентропії вперше було введено Р. Клаузиусом в 1862 р Це одне з найдивовижніших відкриттів, зроблених «на кінчику пера», тобто чисто теоретично.
Незважаючи на цю обставину і відсутність приладів, які б вимірювали ентропію речовини, це поняття виявилося надзвичайно плідним.
ентропія

Слід звернути увагу на особливість цієї формули. Як ми знаємо,
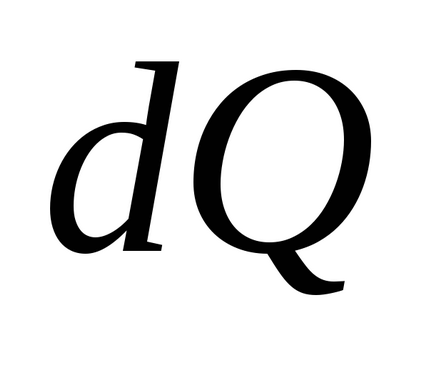
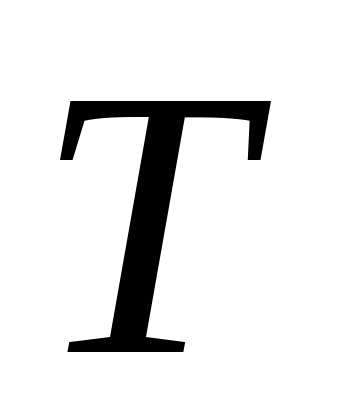


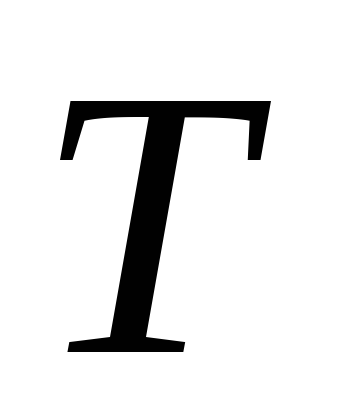
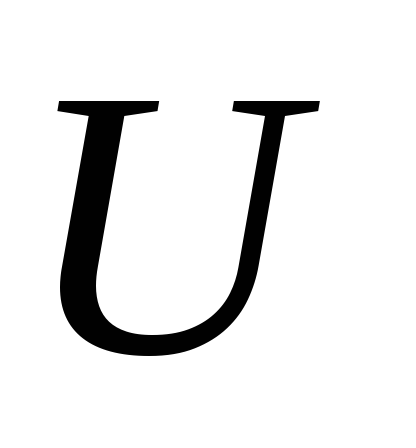
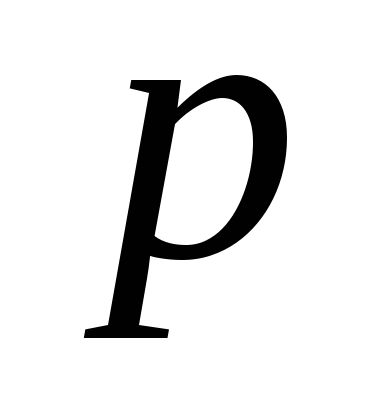


Таким чином, при рівноважної теплопередачі при температурі
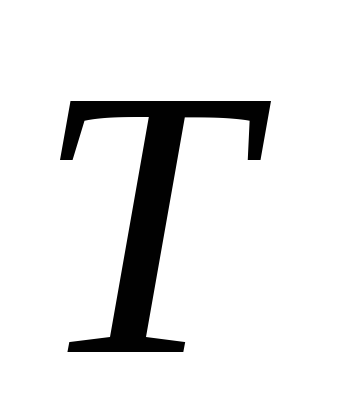
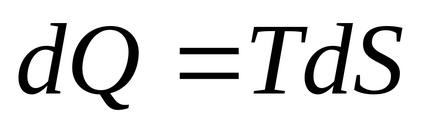
Перший початок термодинаміки можна записати в вигляді:
Нехай у вихідному стані тіла з температурою
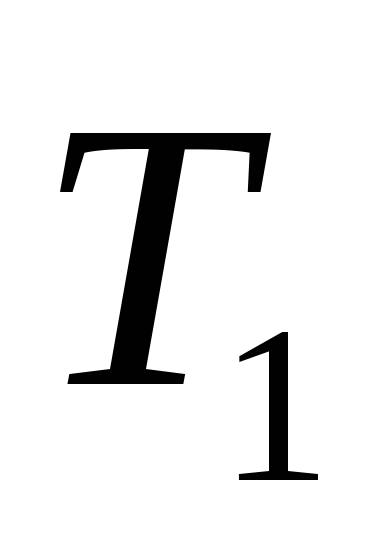
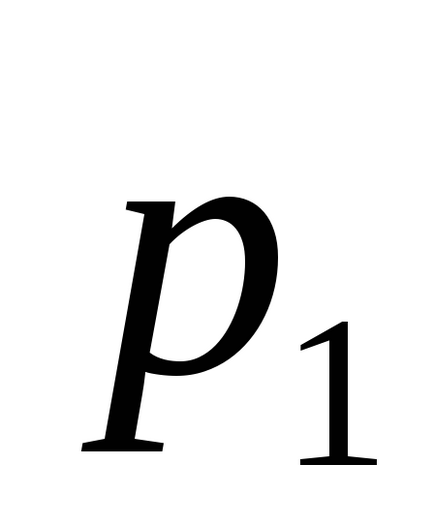
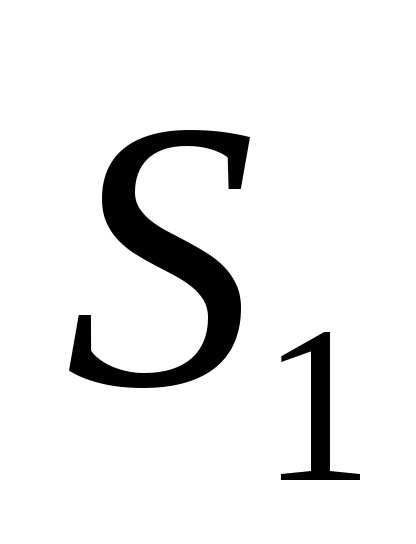
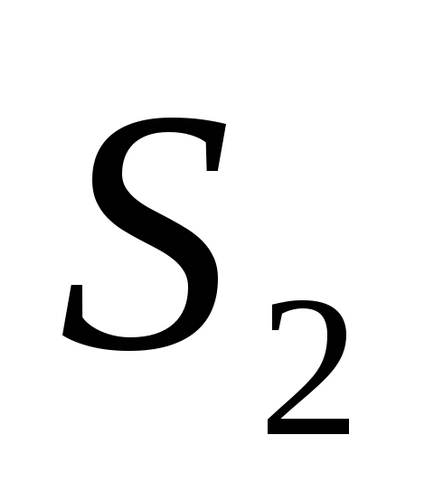
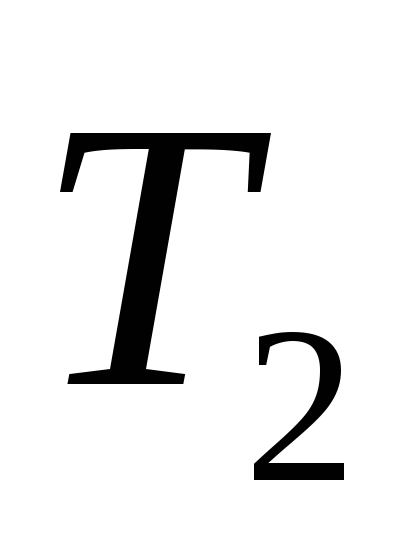
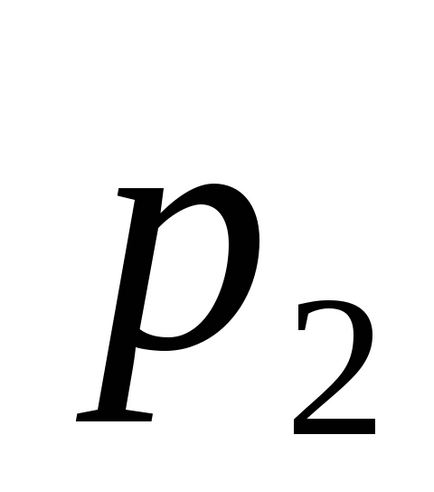
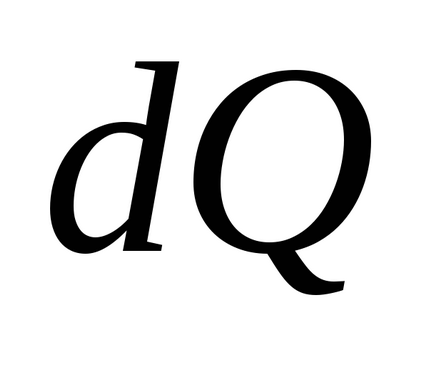
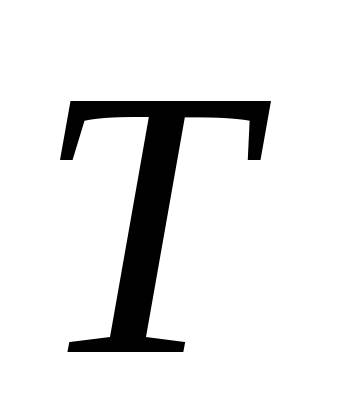
тоді ентропія
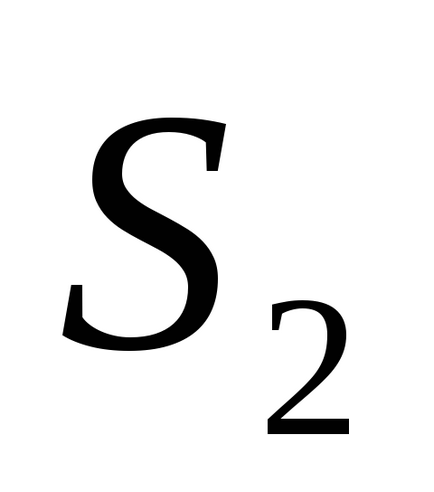
Зокрема, для ізотермічного процесу (
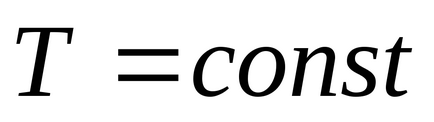
Так як ентропія є функцією стану, то інтеграл (4.3) не залежить від форми кривої, що зображає процес, а визначається тільки початковим і кінцевим станами, тобто межами інтегрування.
1) Ентропія - величина адитивна: ентропія системи з декількох тіл є сумою ентропій кожного тіла
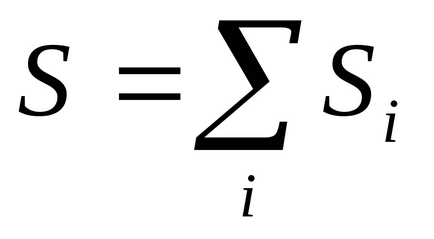
2) В рівноважних процесах без передачі тепла ентропія не змінюється.
При адіабатичному процесі
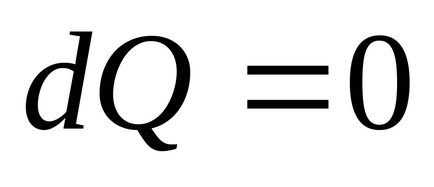
Тому згідно з формулою (4.1) при рівноважному адіабатичному процесі
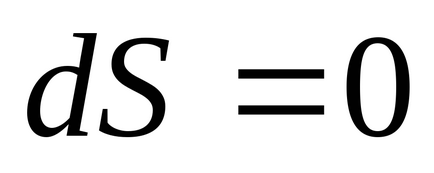
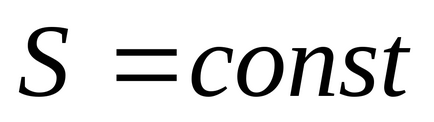
3) При постійному обсязі ентропія є монотонно зростаючою функцією внутрішньої енергії тіла.
Дійсно, при
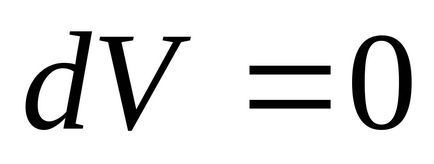
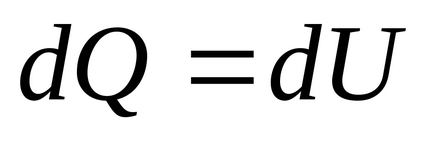
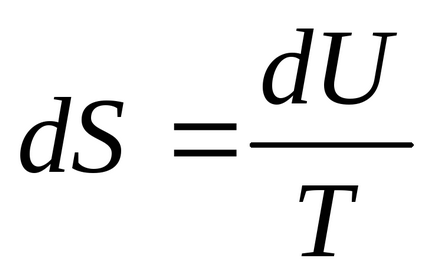
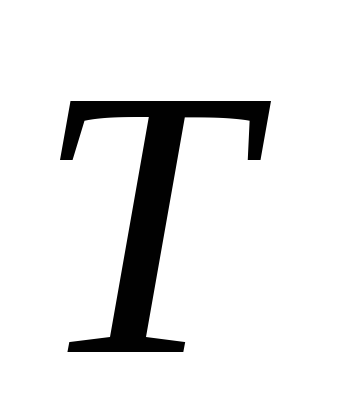
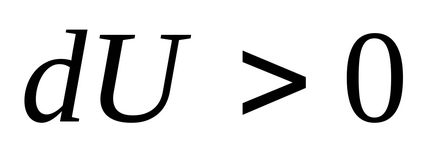
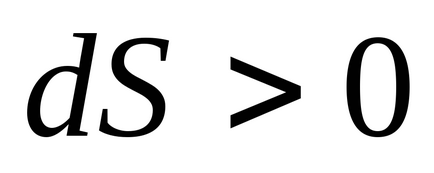
4) Ентропія визначається тільки з точністю до довільної сталої.
Дійсно, відповідно до (4.3) ми можемо обчислити тільки різниця ентропій

5) Завдання внутрішньої енергії як функції обсягу і ентропії
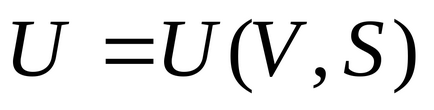
Дійсно, згідно з правилом диференціювання функцій двох змінних
.
З огляду на (4.2), що
,
Ці рівності визначають температуру і тиск по внутрішньої енергії
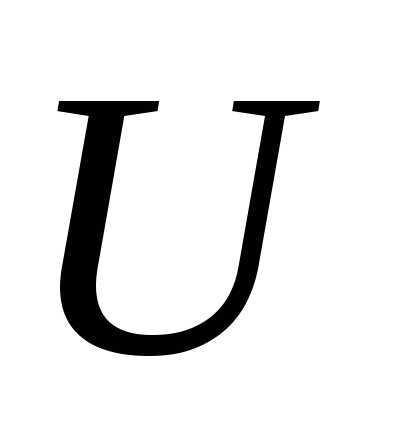
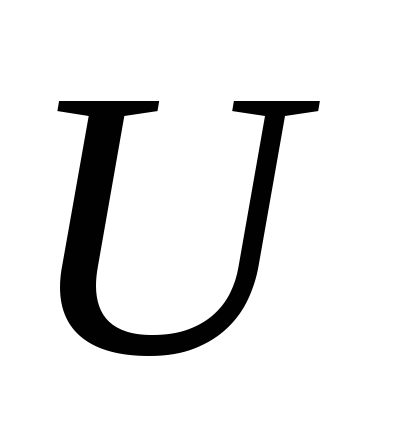
Відзначимо, що рівність
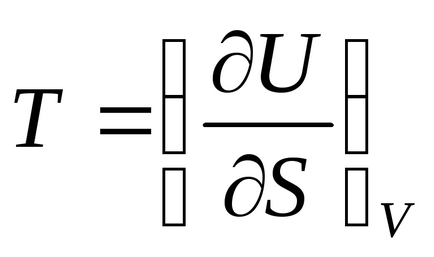
абсолютна температура