Органічні речовини клітини білки
Білки (протеїни. Поліпептиди) - найчисленніші, найбільш різноманітні і мають першорядне значення біополімери. До складу молекул білків входять атоми вуглецю, кисню, водню, азоту і іноді сірки, фосфору і заліза.
Мономерами білків є амінокислоти. які (маючи в своєму складі карбоксильну та аміно групи) мають властивості кислоти і підстави (амфотерни).
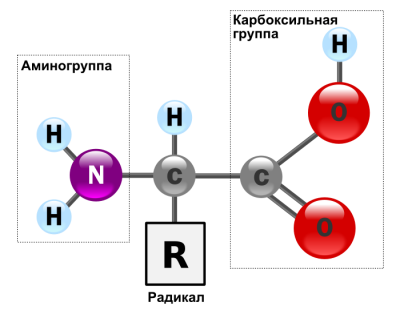
Завдяки цьому амінокислоти можуть з'єднуватися один з одним (їх кількість в одній молекулі може досягати декількох сотень). У зв'язку з цим молекули білків мають великі розміри і їх називають макромолекулами.
Структура білкової молекули
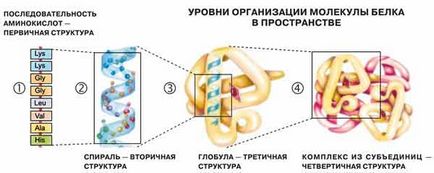
Під структурою білкової молекули розуміють її амінокислотний склад, послідовність мономерів і ступінь скрученности молекули білка.
У молекулах білків зустрічається всього 20 видів різних амінокислот і величезна різноманітність білків створюється за рахунок різного їх поєднання.
- Послідовність амінокислот в складі поліпептидного ланцюга - це первинна структура білка (вона унікальна для будь-якого білка і визначає його форму, властивості і функції). Первинна структура білка унікальна для будь-якого типу білка і визначає форму його молекули, його властивості та функції.
- Довга молекула білка згортається і набуває спочатку вигляд спіралі в результаті утворення водневих зв'язків між СО та -NН групами різних амінокислотних залишків поліпептидного ланцюга (між вуглецем карбоксильної групи однієї амінокислоти і азотом аміногрупи іншої амінокислоти). Ця спіраль - вторинна структура білка.
- Третинна структура білка - тривимірна просторова "упаковка" поліпептидного ланцюга у вигляді глобули (кульки). Міцність третинної структури забезпечується різноманітними зв'язками, що виникають між радикалами амінокислот (гідрофобними, водневими, іонними і дисульфідними S-S зв'язками).
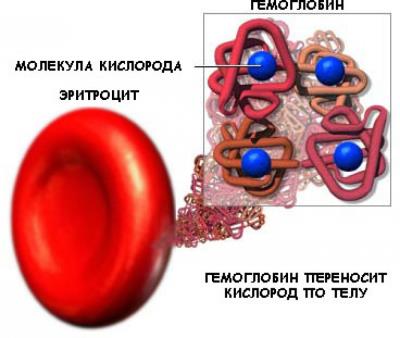
- Деякі білки (наприклад, гемоглобін крові людини) мають четвертинних структуру. Вона виникає в результаті з'єднання декількох макромолекул з третинної структурою в складний комплекс. Четвертичная структура утримується неміцними іонними, водневими і гідрофобними зв'язками.
Структура білків може порушуватися (піддаватися денатурації) при нагріванні, обробці деякими хімічними речовинами, опроміненні та ін. При слабкому впливі розпадається тільки четвертичная структура, при більш сильному - третинна, а потім - вторинна, і білок залишається у вигляді поліпептидного ланцюга. В результаті денатурації білок втрачає здатність виконувати свою функцію.
Порушення четвертичной, третинної і вторинної структур можна зупинити. Цей процес називають ренатурацією.
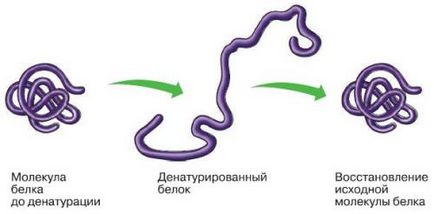
Руйнування первинної структури є незворотнім.
Крім простих білків, що складаються тільки з амінокислот, є ще і складні білки, до складу яких можуть входити вуглеводи (глікопротеїни), жири (ліпопротеїни), нуклеїнові кислоти (нуклеопротеїнами) і ін.
- Каталітична (ферментативна) функція. Спеціальні білки - ферменти - здатні прискорювати біохімічні реакції в клітці в десятки і сотні мільйонів разів. Кожен фермент прискорює одну і тільки одну реакцію. До складу ферментів входять вітаміни.
- Структурна (будівельна) функція - одна з основних функцій білків (білки входять до складу клітинних мембран; білок кератин утворює волосся і нігті; білки колаген та еластин - хрящі та сухожилля).
- Транспортна функція - білки забезпечують активний транспорт іонів через клітинні мембрани (транспортні білки в зовнішній мембрані клітин), транспорт кисню і вуглекислого газу (гемоглобін крові і міоглобін в м'язах), транспорт жирних кислот (білки сироватки крові сприяють переносу ліпідів і жирних кислот, різних біологічно активних речовин).
- Сигнальна функція. Прийом сигналів із зовнішнього середовища і передача інформації в клітину відбувається за рахунок вбудованих в мембрану білків, здатних змінювати свою третинну структуру у відповідь на дію факторів зовнішнього середовища.
- Скорочувальна (рухова) функція - забезпечується скорочувальними білками - актином і міозином (завдяки скоротливі білок рухаються війки і джгутики у найпростіших, переміщаються хромосоми при діленні клітини, скорочуються м'язи у багатоклітинних, удосконалюються інші види руху у живих організмів.

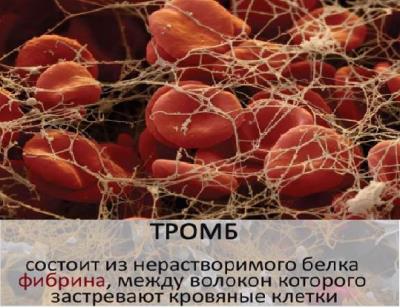
- Захисна функція - антитіла забезпечують імунний захист організму; фібриноген і фібрин захищають організм від крововтрат, утворюючи тромб.