модуль i
Радикал-функціональна і замісна номенклатури спиртів.
Назва спиртів по замісній номенклатурі ІЮПАК утворюється від назви відповідних алканів додатком закінчення «ол»; по радикал - функціональній номенклатурі назву утворюється від назви відповідного радикала з додаванням закінчення «-овий спирт».
Нумерація головного ланцюга починають з того кінця, ближче до якого знаходиться група ОН.
Залежно від того, при якому атомі вуглецю знаходиться гідроксильна група, розрізняють первинні (пропанол-1), вторинні (пропанол-2) і третинні (2-метілпропанол-2) спирти.
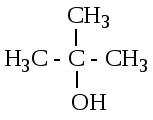
пропанол-1 пропанол-2 2-метілпропанол-2
Ізомерія спиртів.
Для спиртів характерна структурна ізомерія:
Ізомерія вуглецевого ланцюга;
Ізомерія положення функціональної групи.
Фізичні властивості спиртів. Водневий зв'язок.
Перші представники гомологічного ряду спиртів - рідини, вищі спирти - тверді речовини. Відсутність газоподібних спиртів пояснюється здатністю молекул до утворення водневих зв'язків. Перші представники спиртів (метанол, етанол, пропанол) змішуються з водою в будь-яких співвідношеннях за рахунок утворення водневого зв'язку з молекулами води. З ростом молекулярної маси розчинність спиртів у воді різко падає. Вищі спирти практично нерозчинні в воді.
Нижчі спирти володіють характерним алкогольним запахом, запах середніх гомологів сильний і неприємний. Вищі спирти практично не мають запаху, а третинні спирти володіють неприємним запахом цвілі.
Спирти мають аномально високими температурами кипіння в порівнянні з алканами, тіолами простими ефірами. Ці відмінності пояснюються наявністю міжмолекулярних зв'язків в молекулах спиртів.
Механізм утворення міжмолекулярних зв'язків.
Атом кисню в молекулі спирту має велику електронегативність і відтягує на себе електронну щільність від атома водню. при цьому на атомі водню виникає δ +. а на атомі кисню δ -. Тому атом водню електростатично притягається до атому кисню іншої молекули і між ними виникає воднева зв'язок. Молекули пов'язані між собою водневими зв'язками, утворюють асоціати.
Освіта ассоциатов як би збільшує масу спирту і знижує його летючість. Для розриву цих зв'язків потрібна додаткова енергія, цим і пояснюється високі температури кипіння.
Найбільшу схильність до утворення водневих зв'язків виявляють первинні спирти. Для вторинних і особливо третинних спиртів здатність до асоціації знижується, так як утворення водневих зв'язків перешкоджають розгалужені вуглеводневі радикали.