Лекція гетерофункціональних сполуки
Реакційна здатність гетерофункціональних сполук
Реакційну здатність УКРІНФОРМ можна розділити на 2 основні групи.
Реакції, характерні для кожної з функціональних груп спиртів, кетонів, карбонових кислот і т.д. (Дивись попередню лекцію).
Для органічних метаболітів в організмі найбільш важливі реакції окислення - відновлення (ОВР).
Молочна кислота накопичується в м'язах внаслідок гіпоксії і утворюється в процесі розпаду глюкози і інших вуглеводів. В аеробних умовах (достатній кількості О2) молочна кислота окислюється в пировиноградную (ПВК).
де [О] це NAD +. а [Н] це NADH
Порівняємо кислотні властивості цих сполук.
П
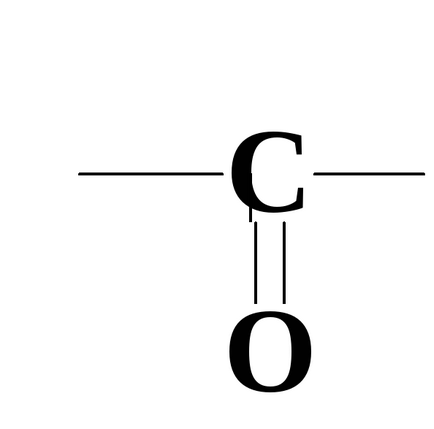
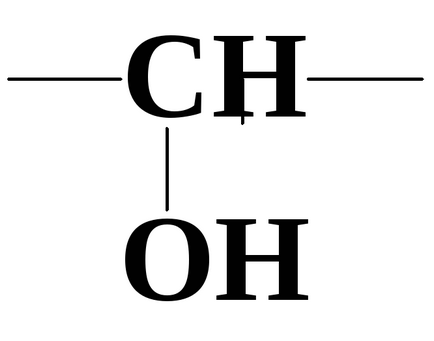
2. Специфічні реакції, пов'язані з взаємним впливом функціональних груп.
а) Реакції декарбоксилювання
α -розташування сильної електроноакцепторні оксо-групи щодо карбоксильної сприяє розщепленню зв'язку С-С і виділенню вуглекислого газу.
Реакція декарбоксилювання - основна реакція освіти вуглекислоти в організмі.
Окислення і декарбоксилювання характерно так само для β-гідрокси- і особливо β-кето кислот. Для β-кетокислот реакція декарбоксилювання протікає легше, ніж для α-, так як відсутній сполучення між групами.
β-гидроксимасляная кислота - проміжний продукт β-окислення жирних кислот. Ця кислота і продукти її перетворення накопичуються у хворих на цукровий діабет і при тривалому голодуванні. β-гідроксимасляної кислота, ацетоуксусная кислота і ацетон складають групу «кетонових або ацетоновихтел».
При нормальному метаболізмі утворюється яблучна кислота, яка поводиться і як - і як -гідроксикислота. Однією зі стадій циклу Кребса є наступна схема реакцій:
б). Кето-енольна таутомерія
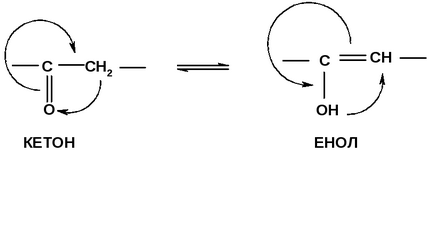
Таутомерія - різновид структурної ізомерії, при якій ізомери легко переходять один в одного і існують тільки спільно, перебуваючи в динамічній рівновазі. У рівновазі завжди переважає більш термодинамічно стабільний ізомер.
До
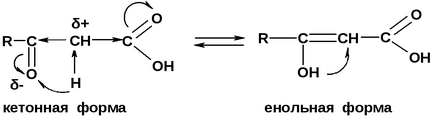
Через електроноакцепторні впливу карбонільної і карбоксильної груп в α - положенні утворюється великий + заряд, і водень стає рухомим. Це призводить до можливості переходу протона від α-СН кислотного центру до карбонільного кисню і виникнення енольной форми.
Зазвичай кето-форма більш стійка, так як СН-кислотний центр має слабшу кислотністю, ніж ОН-кислотний центр, тому ацетоуксусная кислота існує переважно в кето-формі.
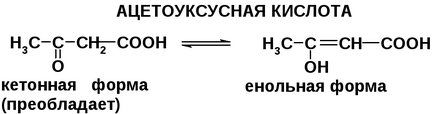
Щавлевооцетова кислота - виняток, вона на 80% існує в енольной формі, Стійкість енольной форми пов'язана з утворенням більш довгому ланцюгу сполучення, що охоплює всю молекулу.
У розчинах ЩУК і АУК присутні обидві форми, тому вони вступають в реакції, характерні для спиртів і оксо-з'єднань.
У
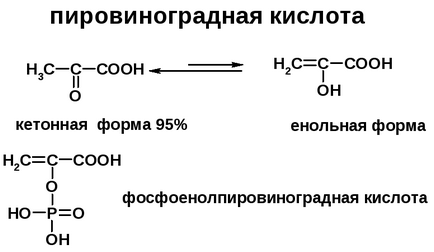
Однак при взаємодії ОН групи енольной форми з фосфорною кислотою утворюється фосфоєнолпіровіноградная (фосфоенолпіруват або ФЕП) кислота. В цьому випадку енольна форма стабілізується рахунок електроноакцепторні впливу фосфорної кислоти і збільшення ланцюга сполучення. В організмі фосфоенолпіруват утворюється в процесі гліколізу.
гидрокси- і амінокислот при нагріванні
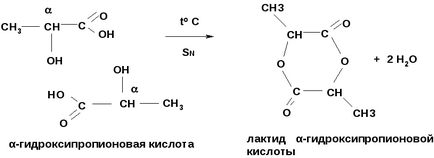
1. -Гідроксикислоти при нагріванні утворюють лактид - циклічні складні ефіри з 2х молекул кислот (SN)
-Амінокислоти при нагріванні утворюють дікетопіперазіни- циклічні аміди з двох молекул амінокислот (SN)
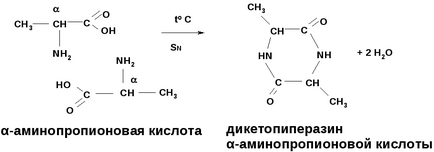
Лактид і дікетопіперазін будучи складними ефірами і амидами гідролізуються у кислому і лужному середовищі. Полілактид використовують в медицині як розсмоктуються матеріали (для виготовлення хірургічних ниток, лікарських капсул)
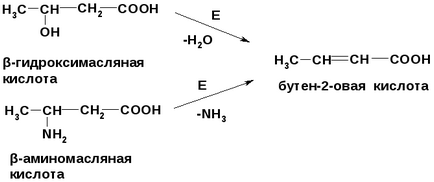
-гідрокси- і-амінокислоти при нагріванні вступають в реакцію елімінування, утворюючи , - ненасичені кислоти
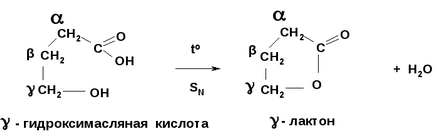
., - Гідроксикислоти при нагріванні утворюють - і - лактони - циклічні складні ефіри гидроксикислот
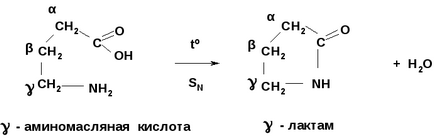
, - Аміноксікіслоти при нагріванні утворюють - і - лактами - циклічні складні ефіри амінокислот
Яблучну і лимонну кислоти можна розглядати як β - гідроксикислоти, тобто при нагріванні вони піддаються елімінування з відщепленням води.
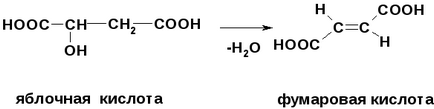
При дегідратації яблучної кислоти утворюється фумарова кислота.
А при дегідратації лимонної - аконітовая, яка потім приєднує воду проти правила Марковникова і перетворюється в ізолімонная.
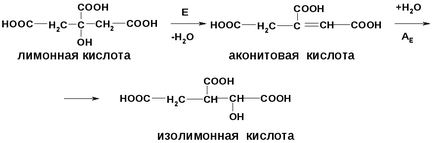
Ці реакції здійснюються в організмі, є стадіями циклу Кребса.
Гетерофункціональні з'єднання ароматичного ряду - лікарські засоби
Велику групу лікарських препаратів гетерофункціональних природискладають похідні бензолу.
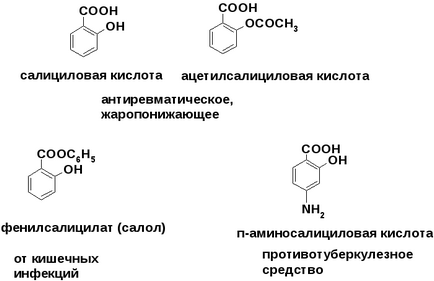
Медичне значення саліцилової кислоти і її похідних см. Стр.276 - 278 підручника «Біоорганічна хімія» під. ред. Н.А. Тюкавкина.