Кислотні дощі (6)
Інтенсифікація діяльності людини в останнє сторіччя призвела до значного порушення сформованого в природі рівноваги, в результаті чого виникло безліч проблем, пов'язаних із захистом навколишнього середовища.
Серед вельми серйозних проблем екологічного плану найбільше занепокоєння викликає наростаюче забруднення повітряного басейну Землі домішками, що мають антропогенну природу. Атмосферне повітря є основним середовищем діяльності біосфери, в тому числі людини. За орієнтовними даними щорічно в атмосферу надходять сотні мільйонів тонн оксидів сірки, азоту, галогенопроізводних та інших з'єднань. Основними джерелами атмосферних забруднень є енергетичні установки, в яких використовується мінеральне паливо, підприємства чорної і кольорової металургії, хімічної і нафтохімічної промисловості, авіаційний і автомобільний транспорт.
Потрапляючи в атмосферу, багато забруднення піддаються хімічним або фотохімічним перетворенням за участю компонентів повітря. Кінцеві продукти хімічних перетворень видаляються з атмосфери з опадами або випадають на поверхню Землі з аерозолями. Потрапляючи на поверхню біологічних об'єктів, будівельних конструкцій та інших предметів, забруднення і продукти їх перетворення інтенсифікують фізико-хімічні процеси руйнування органічних речовин, металів і неорганічних матеріалів.
Збиток, нанесений живій природі атмосферними забрудненнями і продуктам виробничої діяльності людини, важко оцінити, але загибель лісів, забруднення водних басейнів, поширення алергічних захворювань, порушення біологічної рівноваги в екосистемах не в останню чергу пов'язані з високими концентраціями агресивних домішок в атмосфері.
Кислотні дощі
Терміном "кислотні дощі" називають усі види метеорологічних опадів - дощ, сніг, град, туман, дощ зі снігом, - рН яких менше, ніж середнє значення рН дощової води (середній рН для дощової води дорівнює 5.6). Виділяються в процесі людської діяльності двоокис сірки (SO2) і оксиди азоту (NОx) трансформуються в атмосфері землі в кислотообразующие частки. ( "ХХ століття: останні 10 років." С. 91) Ці частинки вступають в реакцію з водою атмосфери, перетворюючи її в розчини кислот, які і знижують рН дощової води. Вперше термін «кислотний дощ» був введений в 1872 році англійським дослідником Ангус Смітом. Його увагу привернув вікторіанський зміг у Манчестері. І хоча вчені того часу відкинули теорію про існування кислотних дощів, сьогодні вже ніхто не сумнівається, що кислотні дощі є однією з причин загибелі життя у водоймах, лісів, врожаїв, і рослинності. Крім того кислотні дощі руйнують будівлі і пам'ятники культури, трубопроводи, виводять з ладу автомобілі, знижують родючість грунтів і можуть призводити до просочування токсичних металів у водоносні шари ґрунту.
Вода звичайного дощу теж є слабокислий розчин. Це відбувається внаслідок того, що природні речовини атмосфери, такі як двоокис вуглецю (СО2), вступають в реакцію з дощовою водою. При цьому утворюється слабка вугільна кислота (CO2 + H3O -> H3CO3). ( "Хімія та суспільство" Американське хімічне товариство. С. 423-424) Тоді як в ідеалі рН дощової води дорівнює 5.6-5.7, в реальному житті показник кислотності (рН) дощової води в одній місцевості може відрізнятися від показника кислотності дощової води в іншій місцевості. Це, перш за все, залежить від складу газів, що містяться в атмосфері тієї чи іншої місцевості, таких як оксид сірки і оксиди азоту.
У 1883 році шведський вчений Сванте Арреніус ввів в обіг два терміни - кислота і підставу. Він назвав кислотами речовини, які при розчиненні у воді утворюють вільні позитивно заряджені іони водню (Н +). Підставами він назвав речовини, які при розчиненні у воді утворюють вільні негативно заряджені гідроксид-іони (ОН). Термін рН використовують в якості показника кислотності води. "Термін рН означає в перекладі з англійської" показник ступеня концентрації іонів водню ". (Хімія і суспільство. С. 428)
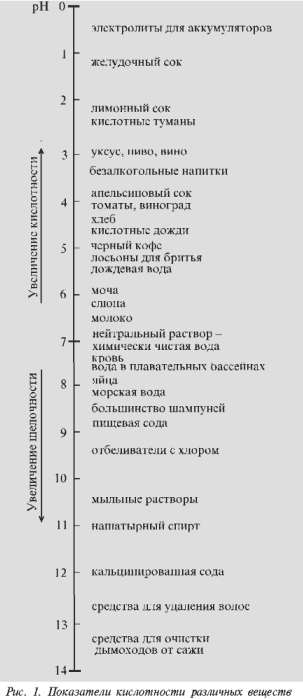
Значення рН вимірюється на шкалі від 0 до 14. У воді і водних розчинах присутні як іони водню (Н +), так і гідроксид-іони (ОН). Коли концентрація іонів водню (Н +) в воді або розчині дорівнює концентрації гідроксид-іонів (ОН-) в тому ж розчині, то такий розчин є нейтральним. Значення рН нейтрального розчину дорівнюють 7 (на шкалі від 0 до 14). Як ви вже знаєте, при розчиненні кислот у воді підвищується концентрація вільних іонів водню (Н +). Вони то і підвищують кислотність води або, іншими словами, рН води. При цьому, з підвищенням концентрації іонів водню (Н +) знижується концентрація гідроксид-іонів (ОН-). Ті розчини, значення рН яких на наведеної шкалою знаходиться в межах від 0 до 7 до 14, називаються лужними.
Слід звернути увагу ще на одну особливість шкали рН. Кожна наступна сходинка на шкалі рН говорить про десятикратному зменшенні концентрації іонів водню (Н +) (і відповідно кислотності) в розчині і збільшенні концентрації гідроксид-іонів (ОН-). Наприклад, кислотність речовини зі значенням рН4 в десять разів вище кислотності речовини зі значенням рН5, в сто разів вище, ніж кислотність речовини зі значенням рН6 і в сто тисяч разів вище, ніж кислотність речовини зі значенням рН9.
Кислотні дощі утворюється в результаті реакції між водою і такими забруднюючими речовинами, як оксид сірки (SO2) і різними оксидами азоту (NOх). Ці речовини викидаються в атмосферу автомобільним транспортом, в результаті діяльності металургійних підприємств і електростанцій, а також при спалюванні вугілля і деревини. Вступаючи в реакцію з водою атмосфери, вони перетворюються в розчини кислот - сірчаної, сірчистої, азотистої і азотної. Потім, разом зі снігом або дощем, вони випадають на землю.
Кислотність водного розчину визначається присутністю в ньому позитивних водневих іонів Н + і характеризується концентрацією цих іонів в одному літрі розчину C (H +) (моль / л або г / л). Лужність водного розчину визначається присутністю гідроксильних іонів ОН і характеризується їх концентрацією C (ОН -).
Як показують розрахунки, для водних розчинів твір молярних концентрацій водневих і гідроксильних іонів - величина постійна, рівна
C (H +) C (ОН -) = 10-14,
іншими словами, кислотність і лужність взаємопов'язані: збільшення кислотності призводить до зниження лужності, і навпаки.
Р
Зі сказаного випливає, що для кислих середовищ виконується умова:
для лужних середовищ:
На практиці ступінь кислотності (або лужності) розчину виражається більш зручним водневим показником рН, що представляє собою негативний десятковий логарифм молярної концентрації водневих іонів:
Наприклад, якщо в розчині концентрація водневих іонів дорівнює 10-5 моль / л, то показник кислотності цього розчину рН = 5. При цьому зміни показника кислотності рН на одиницю відповідає десятикратне зміна концентрації водневих іонів в розчині. Так, концентрація водневих іонів в середовищі з рН = 2 в 10, 100 і 1000 разів вище, ніж в середовищі з рН = 3, 4 і 5 відповідно.
У кислих розчинах рН 7, і чим більше, тим вище лужність розчину.
Шкала кислотності йде від рН = 0 (украй висока кислотність) через рН = 7 (нейтральне середовище) до рН = 14 (вкрай висока лужність).
Чистий природна, зокрема дощова, вода під час відсутності забруднювачів проте має слабокислу реакцію (рН = 5,6), оскільки в ній легко розчиняється вуглекислий газ з утворенням слабкої вугільної кислоти:
СО2 + Н2 Про Н2 СО3.
Для визначення показника кислотності використовують різні рН-метри, зокрема дорогі електронні прилади. Простим способом визначення характеру середовища є застосування індикаторів - хімічних речовин, забарвлення яких змінюється в залежності від рН середовища. Найбільш поширені індикатори - фенолфталеїн, метилоранж, лакмус, а також природні барвники з червоної капусти і чорної смородини.
Наслідки кислотних опадів.
У 70-х рр. в річках і озерах скандинавських країн стала зникати риба, сніг в горах забарвиться в сірий колір, листя з дерев завчасно встелена землю. Дуже скоро ті ж явища помітили в США, Канаді, Західній Європі. У Німеччині постраждало 30%, а місцями 50% лісів. І все це відбувається далеко від міст і промислових них центрів. З'ясувалося, що причина всіх цих бід - кислотні дощі.
Показник рН змінюється в різних водоймах, але в ненарушен-ної природному середовищу діапазон цих змін суворо обмежений. Природні води і грунту мають буферними можливостями, вони здатні нейтралізувати певну частину кислоти і со-зберігати середу. Однак очевидно, що буферні здібності при-пологи не безмежні.
У водойми, що постраждали від кислотних дощів, нове життя можуть вдихнути невеликі кількості фосфатних добрив; вони допомагають планктону засвоювати нітрати, що веде до зниження кислотності води. Використання фосфату дешевше, ніж вапна, крім того, фосфат чинить менший вплив на хімію води.
Земля і рослини, звичайно, теж страждають від кислотних дож-дей: знижується продуктивність грунтів, скорочується надходження пі-тательних речовин, міняється склад грунтових мікроорганізмів.
Величезної шкоди завдають кислотні дощі лісам. Ліси висихає-ють, розвивається суховершинность на великих площах. Кислота збільшує рухливість в грунтах алюмінію, який токсичний для дрібних коренів, і це призводить до пригнічення листя і хвої, крихке-сти гілок. Особливо страждають хвойні дерева, тому що хвоя змінюється рідше, ніж листя, і тому накопичує більше шкоди-них речовин за один і той же період. Хвойні дерева жовтіють, у них зріджуються крони, пошкоджуються дрібні коріння. Але і у ли-ських дерев змінюється забарвлення листя, передчасно опадає листя, гине частина крони, пошкоджується кора. Природний-ного відновлення хвойних і листяних лісів не відбувається.
Все більшої шкоди кислотні дощі завдають части-тиментом культурам: пошкоджуються покривні тканини рослин, змінюється обмін речовин в клітинах, рослини сповільнюють ріст і розвиток, зменшується їх опірність до хвороб і паразитуючих-там, падає врожайність.
Фахівці американського університету штату Північна Кароліна вивчили вплив, який чиниться кислотними дощу-ми на рослини в період їх максимальної сприйнятливості до факторів зовнішнього середовища. Під впливом кислотних дощів не-посередньо після запилення в качанах кукурудзи формирова-лось менше зерен, ніж при зрошенні чистою водою. Причому чим більше в дощовій воді містилося кислоти, тим менше зерен утворювалося в качанах. Разом з тим з'ясувалося, що кислотні дощі, що пройшли до запилення, не чинили помітного впливу на формування зерен.
Проведено дослідження ступеня сприйнятливості до кислот-ним дощів 18 видів сільськогосподарських культур і 11 видів декоративних рослин на ранніх стадіях росту. Найбільш подвер-женнимі шкідливому впливу виявилися листя томатів, сої, квасолі, тютюну, баклажанів, соняшнику і бавовнику. Найменш сприйнятливими - озима пшениця, кукурудза, салат, люцерна і конюшина.
Кислотні дощі не тільки вбивають живу природу, а й руйнують пам'ятники архітектури. Міцний, твердий мармур, суміш оксидів кальцію (СаО і СО2), реагує з розчином сер-ної кислоти і перетворюється в гіпс (СаSО4). Зміна температур, потоки дощу і вітер руйнують цей м'який матеріал. Історія-етичні пам'ятники Греції і Риму, простоявши тисячоліття, в пос-Ледньов роки руйнуються прямо на очах. Така ж доля загрожує і Тадж-Махалу - шедевру індійської архітектури періоду Вели-ких Моголів, в Лондоні - Тауеру і Вестмінстерського абатства. На соборі Св. Павла в Римі шар портлендського вапняку роз'їдені на 2,5 см. У Голландії статуї на соборі Св. Іоанна тануть, як льодяники. Чорними відкладеннями поїдені королівський палац на площі Дам в Амстердамі.
Понад 100 тис. Найцінніших вітражів, що прикрашають собори в скинії, Контербері, Кельні, Ерфурті, Празі, Берні, в інших містах Європи можуть бути повністю втрачені в найближчі 15- 20 років.
Вивчивши нові дані про кислотність опадів, що випадають в різних регіонах Західної Європи, і про вплив їх на зда-вання і споруди, співробітники Дублінського університету (Ір-Ланд) виявили, що саме катастрофічне становище склади-лось в центрі Манчестера (Великобританія), де за 20 місяців кислотні опади розчинили більше 120 г на 1 м 2 каменю (пісковиків-ка, мармуру або вапняку).
Місто постраждало дуже сильно, хоча загальна кількість опадів в спостережуваний відрізок часу там було вкрай низьким. Очевидний-но, занадто висока була ступінь їх кислотності.
За Манчестером слід Ліпхун (графство Гемпшир в Вели-кобрітанія) і Антверпен (Бельгія), де кожен камінь під від-критим небом втратив 100 г з 1 м 2. Навіть такі відомі загряз-нення атмосфери міста, як Афіни, Копенгаген і Амстер- дам, піддалися кислотному руйнування в значно мен-ший ступеня.
Страждають від кислотних дощів і люди, вимушені споживати питну воду, забруднену токсичними металами - ртуттю, свинцем, кадмієм і т.п.
Рятувати природу від закислення необхідно. Для цього прийде-ся різко знизити викиди в атмосферу оксидів сірки і азоту, але в першу чергу сірчистого газу, так як саме сірчана кислота і її солі на 70-80% обумовлюють кислотність дощів, випадаю-щих на великих відстанях від місця промислового викиду.
Система контролю забруднення сніжного покриву на територі-рііУкаіни здійснюється на 625 пунктах, обстежують площу в 15 млн. Км2. Проби забирають на наявність іонів сульфату, нітрату амонію, важких металів, визначають значення рН.
Природні опади мають різну кислотність, але в середньому рН = 5,6. Кислотні опади з рН 1 2 Дивитись всі