Явища в рідких середовищах і на поверхнях розділу фаз
У зоні зварювання плавленням вельми важливе значення мають процеси, що протікають в рідких фазах і на межі поділу фаз.
Фазою в фізичної хімії називається однорідна частина системи, отделеннаяот інших її частейвідімимі поверхнями розділу.
Фазами в зоні сваркіявляютсягазовая среда, рідкий шлак, жідкійітвердий метали.
До числа найважливіших процесів в зоні зварювання слід отнестівзаімодействіе рідких фаз з газами і оксидами.
Розчинення газів. Припустимо, що естьдвухфазная система, що складається з газової і рідкої фаз, і один із компонентів газової фази може розчинятися в рідкій фазі.
Хімічні елементи (гази) можуть створювати в рідині хімічні сполуки або розчини: в рідкій фазі з'являються молекули реагуючих компонентів або іони молекул.
Розчинення: нейтральні атоми (молекули) розчинної речовини проникають в товщу розчинника і займають місце між атомами і молекулами розчинника. Бульбашки.
Між рідкою і газовою фазами відбувається обмін газовим компонентом.
При заданій температурі швидкість розчинення газу в рідкій фазі можна счітатьпропорціональной його парціальному давленіюрв газовій фазі,
а швидкість його видалення з рідини -пропорційність його концентрацііСв рідкій фазі.
У стані рівноваги швидкість розчинення дорівнює швидкості видалення.
У рівноважному стані концентрація газу в жідкостіС = k * p де k - константа Генрі, що визначає розчинність газу в рідині при даній температурі; р - парціальний тиск газу в газовій фазі, am. (Cіpявляются показниками концентрації компонента, відповідно, в рідині і газі. )
Ця залежність була встановлена Генрі і названа законом Генрі.
Закон Генрі справедливий лише при малій розчинності і в тому випадку, еслірастворенний газ не вступає з рідиною в хімічні реакції.
Цей закон застосуємо до ідеальних і розведених розчинів. Для всіх компонентів (газів і рідин) є граничні максимальні значення розчинення (стан насичення), які залежать від температури і вище яких рідина не приймає газ.
У більшості випадків при розчиненні газів в рідкому металі з підвищенням температури граничне насичення возрастает.Но при наближенні до кипіння - знижується. Якщо концентрація газу в рідкому металі при заданій температурі перевищує стан насичення, то надлишок починає виділятися у вигляді газових бульбашок (пори).
У рідкому металі розчиняються гази, що знаходяться в атомарному стані, і ті з них, коториеімеют незаповнені валентні оболонки (Н, N) і не утворюють з металом іонних зв'язків (подібно кисню).
Звичайним станом таких газів є молекулярне, тому перед розчиненням повинна пройти їх дисоціація,
Закон розподілу речовини в змішуються розчинниках.
Розглянемо систему, що складається з двох рідка фаза верб, що не розчиняються одна в іншій, і третій - газової фази, один з компонентів якої може розчинятися як у фазі, так і в фазеВ. Відповідно до закону Генрі можна записати, що концентрація газу в кожній з фаз при одній і тій же температурі звідки випливає, що
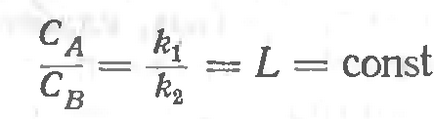
ПостояннаяLназиваетсякоеффіціентоміліконстантой розподілу, а співвідношення є математичним вираженіемзакона розподілу Нернста.
Цей закон застосуємо до речовини, що знаходиться в будь-якому агрегатному стані, якщо воно розчинно в двох дотичних рідких розчинниках. Формулювання закону розподілу така: Кожна речовина распределяетсямежду двома розчинниками так, що відношення концентраційего в обох розчинниках залишається постійним. Слід при цьому мати на увазі, чтоеслі в двох змішуються розчинниках одновременноможет розчинятися кілька речовин. між собою не взаємодіють, токаждое з них буде розчинятися незалежно від іншого, маючи свою константу розподілу.
У зоні зварювання плавленням два змішуються розчинника - це рідкі метал і шлак.
Здатність деяких з'єднань розчинятися в цих двох фазах використовується для очищення металу від таких з'єднань. Так, при зварюванні сталей в рідкому металі досить енергійно може образовиватьсязакісь заліза, що погіршує властивості сталі.Закісь заліза добре розчинна не тільки в рідкому металі, але і в рідкому шлаку, і розподіл її між цими двома різними за властивостями рідинами підкоряється закону розподілу.
Домовившись в подальшому укладати концентрації речовин, що знаходяться в шлаку, в круглі дужки, а речовин, находящіхсяв рідкому металі, - в квадратні, запишемо
Зменшення концентрації вільної закису заліза в шлаку може викликати зниження вмісту її і в рідкому металі: з металу вона буде переходити в шлак, так як для даної температури значення константи розподілу постійно. На цьому і засноване диффузионное розкислення металу.
Таким же чином можна знизити і концентрацію сірки в металі. На дії закону розподілу засновано також отримання методом електрошлакової переплавки вельми рафінованих металів і сплавів.
Поняття про поверхневої енергії.
Різні хімічні процеси, що протікають в гетерогенних системах, зазвичай починають розвиватися з поверхонь розділу фаз, переміщаючись потім далі, вглиб системи.
Умови існування молекул поверхневого шару відрізняються від тих, в яких знаходяться молекули внутрішніх шарів. Тому властивості поверхні відрізняються від властивостей внутрішніх шарів речовини.
Особливості властивостей поверхневих шарів речовини виявляються на будь-якій поверхні розділу фаз, але
особливо сильно - в системі «рідина - газ»,
слабкіше - на кордоні двох змішуються рідин, а також в системі «тверде тіло - рідина»,
ще слабше - на межі поділу твердих тіл.
Прояв цих властивостей є результат наявності на поверхні розділу фаз певної енергії - поверхневої енергії, або енергііповерхностного натягу.
Величина поверхневого натягу залежить не тільки від рідини, але і від середовища, яка знаходиться поруч з нею, так як це середовище може впливати на поверхневі молекули рідини. Змінюючи прикордонну середу, можна досить сильно впливати на величину поверхневого натягу жідкості.Вещества, що сприяють зменшенню величини поверхневого натягу, називаються поверхнево-активними, а речовини, слабо впливають на поверхневий натяг, поверхневі-неактивними. Наприклад, група лужних і лужноземельних металів і більшість солей, ними утворених, відносяться до поверхнево-активних веществам.Етім користуються при пайку і зварюванні, прагнучи домогтися кращої змочуваності поверхні твердого металу рідким металом і легшого розчинення крапель електродного металу в зварювальній ванні.
Величина поверхневого натягу впливає на чисельні значення пружності парів і розчинність даного речовини. Якщо рідина має форму краплі, то зі зменшенням розміру крапель пружність парів над ними увелічівается.Ето пояснюється впливом ступеня кривизни випаровує поверхності.Отсюда слід, що малі краплі завжди мають більший тиск пара. ніж великі, і тому легше іспаряются.Освежітелі повітря в аерозольній упаковці.
Що стосується впливу поверхневого натягу на розчинність, то відомо, що краплі малого розміру розчиняються краще, ніж великі.
Те ж відбувається і з зернами в твердому металі: при високих температурах великі зерна ростуть за рахунок дрібних як менш стійких (при нагріванні великі зерна ростуть за рахунок дрібних).
Істотний вплив на величину поверхневого натягу надає зміна температури. Підвищення температури призводить до зниження поверхневого натягу, так як внаслідок розширення речовини послаблюються сили тяжіння між молекулами як всередині речовини, так і в його поверхневому шарі.
При деякій температурі поверхневий натяг рідини стає рівним нулю і зникає розділ між рідкої і газової фазой.Ета температура названа температурою абсолютного кипіння, або критичною температурою, вище якої речовина не може знаходитися в рідкому стані.
Природу явища адсорбції можна пояснити наступним чином. Молекули або атоми речовини, розташовані на поверхні, мають, на відміну від молекул і атомів, що знаходяться всередині речовини, вільними, зайнятими силами зв'язку. Якщо у такій поверхні виявляться, припустимо, атоми газу, то вони можуть утримуватися молекулами або атомами речовини, що мають вільні сили зв'язку, т. Е. Адсорбироваться. Якщо сили зв'язку досить великі, адсорбований атом залишиться у поверхні, якщо слабкі - він може покинути поверхню речовини.
Збільшення температури, при якій протікає адсорбція, внаслідок збільшення енергії теплових коливань адсорбованих частинок призводить до того, що частина їх повертається в газове середовище і адсорбція зменшується.
Зниження температури, навпаки, визиваетвозрастаніе адсорбції, поки на поверхні не утворюється тонкий шар газу в кілька молекулярних шарів.
Аналогічно на розвиток адсорбції впливає і зменшення тиску: у міру зниження давленіяадсорбція зменшується.
При збільшенні тиску адсорбція посилюється.
Крім температури і тиску, на розвиток процесу адсорбції значно впливає природа адсорбируемого речовини і раствора.Із хімічних компонентів сильніше адсорбуються ті, у яких температура кипіння і випаровування в жідкостьвише. тому при нормальних умовах вони менш «активні» (низькі швидкості молекул).
Розвитку адсорбції сприяє наявність в розчині поверхнево-активних речовин, що знижують величину поверхневого натягу раствора.ВУС.
Процес адсорбції займає дуже короткий проміжок часу (частки секунди), подальше ж переміщення поглиненого поверхневого продукту в глиб речовини відбувається набагато повільніше - за рахунок дифузії або шляхом механічного перемішування.
Поняття про в'язкості рідин.
В'язкістю, або внутрішнім тертям, називається опір, який чиниться рідким середовищем при переміщенні одних її частин щодо інших. Відомо, що при переміщенні рідини по каналу (рис. 89,6) швидкість різних верств рідини буде неоднакова: шари під стінами каналу будуть переміщатися повільніше, ніж внутрішні. Зміна швидкості переміщення шарів рідини описується параболічною кривою (рис. 89, а).
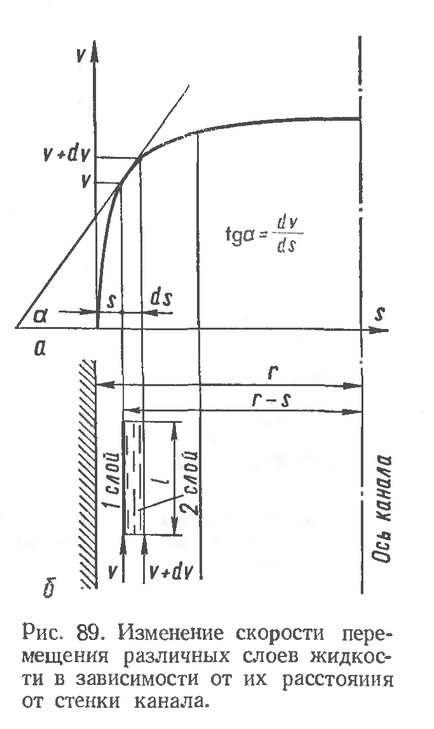
Величина сили внутрішнього тертя між шарами визначиться наступною залежністю (закон Ньютона): сила опору руху пропорційна градієнту швидкості переміщення шарів.
де Р - сила внутрішнього тертя між слояміжідкості, що переміщаються з різною швидкістю, дин;
dv / ds - градієнт швидкості, що характеризує зміну швидкості переміщення шарів рідини в напрямку, перпендикулярному до їхнього руху, сек-1;
- коефіцієнт пропорційності, що залежить від природи, складу і температури рідини; він же являетсякоеффіціентомабсолютной в'язкості, ілікоеффіціентом внутреннеготренія.
За одиницю абсолютної в'язкості рідин - пуаз (пз) - прийнята в'язкість такої рідини, в якій сила Iдін переміщує шар рідини 1см2, по відношенню до іншого такого ж шару, що знаходиться від першого на відстані 1см, зі швидкістю 1см / сек.
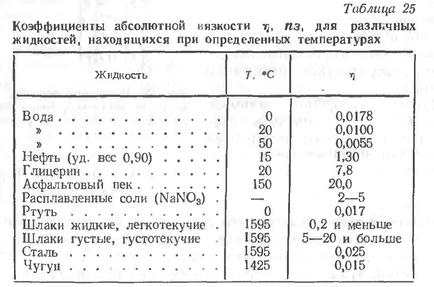
У зварювальних процесах, природно, найбільший інтерес представляє в'язкість шлаків, що утворюються на поверхні рідкого металу, так як від величини цього показника і характеру його зміни в процесі зварювання залежать технологічні властивості застосовуваних покриттів і флюсів, ступінь завершеності металургійних процесів і т. П.
В'язкість рідин, і зварювальних шлаків зокрема, дуже залежить від температури і в загальному випадку з підвищенням останньої зменшується. Зі збільшенням температури шлаки, знижуючи свою в'язкість, проходять через три характерних стану:
1 - крихке, що відповідає в'язкості H> 10 13 пз;
3 - рідинних - при <10 пз.
Для визначення в'язкості рідких шлаків застосовують прилад, званий віскозиметром.
1. Метод падіння кульки заснований на вимірюванні швидкості падіння платинового кульки в досліджуваній рідині. У цьому випадку коефіцієнт в'язкості визначається за формулою Стокса.
2. Метод обертання циліндра має кілька різновидів, однією з яких є вимірювання швидкості обертання циліндра в досліджуваній рідині під дією певного крутного моменту. Вискозиметр градуюється по рідини, в'язкість якої відома (розчини цукру, гліцерину).
Пружність парів всякого речовини з підвищенням температури зростає.
Пружність пара - парціальний тиск парів хімічної речовини в повітрі, яке будучи в рідкому або твердому стані, знаходиться в контакті з повітрям.
Процес утворення парів при температурах нижче точки плавлення речовини називається сублімацією (сублімацією), вище точки плавлення - випаровуванням.
При випаровуванні поряд з виходом частинок з рідини. пропорційним їх кількості на поверхні рідкої фази, спостерігається і зворотний процес - повернення їх з газової фази в рідину. Тому определеннойупругості пара над рідиною буде відповідати рівновагу цих двох зустрічних процесів.
Підвищення вологості повітря шляхом використання акваріумів і зволожувачів повітря.
Температура, при якій пружність парів дорівнює тиску навколишнього атмосфери, називається точкою кипіння. Випаровування при цій температурі йде вже не тільки на вільної поверхні, але і по всьому об'єму рідини. У табл. 26 наведені точки кипіння і питома прихована теплота пароутворення для деяких елементів.
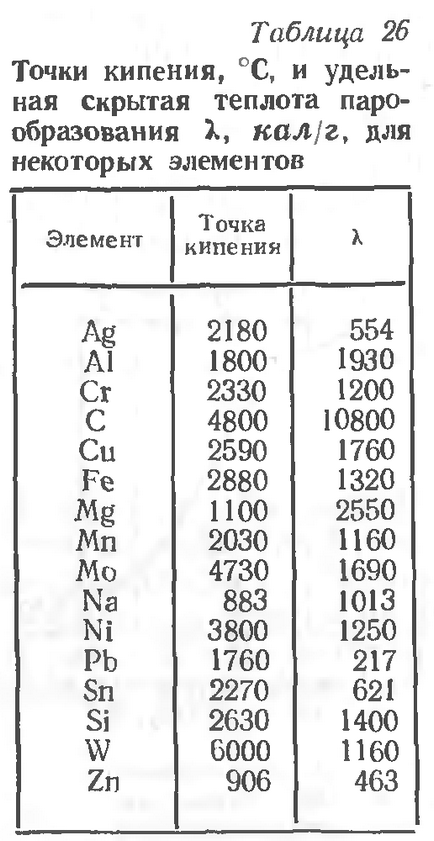
З табл. випливає, що деякі метали киплять при температурі, характерною для дугового розряду. Наявність парів металів в зоні зварювальної дуги (пружність парів) сприяє одному з видів перенесення електродного металу на виріб - перенесення парами металу.
Питома прихована теплота пароутворення, залежить від температури і тиску. Цю залежність можна визначити на підставі законів термодинаміки. Але введення складності обчислень і нестачі точних значень констант, визначаючи пружність парів, часто обмежуються грубо наближеними рівняннями, побудованими на підставі обробки експериментальних даних для декількох температур.
Теплота випаровування з твердого стану, т. Е. Сублімації або сублімації, дорівнює сумі теплот плавлення і пароутворення.
Все викладене ставилося до чистих речовин. Для суміші різних речовин явище значно ускладнюється.
Газову атмосферу при зварюванні металів утворюють, крім складових повітря. пари металу і хімічних сполук. що входять до складу електродних покриттів або флюсів. і продукти їх розкладання.
Перенесення металу за рахунок парів незначний .В умовах високої температури дугового розряду все метали, маючи високу пружність пара, здавалося б, повинні перебувати в газоподібному стані. Але швидкість випаровування конечна, перенесення металу у вигляді крапель через дугового проміжок відбувається дуже швидко і тому в процесі польоту краплі киплять і лише частково випаровуються.
Втрата легуючих елементовза рахунок випаровування іокісленія.
Елементи з високою температурою кипіння і малою пружністю парів випаровуються не настільки інтенсивно (наприклад, W, Ni).
Навпаки, елементи, що мають невисоку температуру кипіння і високу пружність парів, випаровуються дуже енергійно (Zn, К, Na, Са, Mg, Мп і ін.).
Так, для кальцію підвищення температури на 100-200 ° С викликає збільшення пружності пара в сотні разів. в той же времядля заліза збільшення температури на 300 ° С призводить до збільшення пружності пара тільки в 10 разів.