хімічний еквівалент
Мета роботи: визначити еквівалент простого і складного речовини
Відповідно до закону еквівалентів, речовини з'єднуються або взаємно заміняють один одного в кількостях, рівних або пропор-нальних їх еквівалентів.
Еквівалентом речовини називається таке його кількість, яке з'єднується з 1 молем атомів водню або заміщує ту ж кількість атомів водню в хімічних реакціях. Еквівалентної масою називається маса 1 еквівалента речовини. Та-ким чином, еквіваленти виражаються в молях, а їх еквівалентні маси в г / моль. Наприклад, в з'єднаннях HCl, H2 O еквіваленти хлору і киць-лорода рівні відповідно 1 молю, 1/2 благаючи, а еквівалентні маси - 35,45 г / моль; 15/2 = 8 г / моль.
Еквівалентним об'ємом називається обсяг, яку він обіймав за даних умов 1 еквівалентом речовини.
Значення еквівалентного обсягу знаходять з того, що міль-ний обсяг будь-якого газу дорівнює 22,4 л / моль. При нормальних умо-вах - 22,4 або містять по 2 благаючи атомів водню або кисню, тому що еквівалент водню дорівнює 1 молю, еквівалент кисню - 0,5 благаючи, то в22,4 л Н2 містяться 2 еквівалента водню, а 22,4 л О2 - 4 еквівалента кисню. Отже, еквівалентний обсяг водню дорівнює 22,4. 2 = 11,2 л / моль, а еквівалентний об'єм кисню дорівнює 22,4. 4 = 5,6 л / моль.
Іноді зручніше користуватися іншим формулюванням закону еквівалентів: маси (обсяги) реагують один з одним речовин, пропорційні їх еквівалентним масам (обсягами).
Математичне вираження закону еквівалентів
Експериментальне визначення еквіваленту речовини сво-диться до встановлення складу їх водневих або кисневих з'єднань.
Еквіваленти визначають за даними різних з'єднань або на підставі результатів заміщення одного еквівалента іншим. Якщо елементи утворюють сполуки воднем або кисло-родом, то еквівалент його може бути визначений безпосередньо з цього з'єднання. Це так зване "пряме визначення".
Якщо елемент витісняє водень з його сполук, то еквівалентні-валент такого елемента може бути визначений за кількістю виділеного водню. Цей метод називається "методом витіснення".
Часто застосовується "непрямий метод" складається в тому, що еквівалент визначається по з'єднанню з іншим елементом, еквівалент якого відомий. Теоретичне значення еквівалента визначається на основі періодичної системи Д. І. Менделєєва.
Виходячи з мольной маси його атомів (А) і його валентності в даному з'єднанні:
еквіваленти служать, головним чином, для визначення атомних мас.
Елементи зі змінною валентністю мають кілька значень еквівалентів.
Поняття про еквівалентах і закон еквівалентів поширюються на складні речовини: солі, кислоти, підстави, оксиди.
Еквівалентом складного речовини називається таке його кількість, яке взаємодіє з еквівалентом іншої речовини.
Еквівалентні маси речовин обчислюють, виходячи з його моль-ної маси. Еквівалентна маса кислоти дорівнює її мольной масі, поділеній на основність кислоти:
Еквівалентна маса підстави дорівнює його мольной масі, поділеній на валентність металу, що утворює основу:
Еквівалентна маса солі дорівнює її мольной масі, поділеній на добуток кількості атомів металу на його валентність:
Еквівалентна маса оксиду дорівнює його мольной масі, поділеній на добуток кількості атомів елемента і його валентність:
або 3 оксиду = 3 елементи + 3 кисню:
Подібно еквівалентної масі елемента, еквівалентна маса складного речовини може мати кілька значень:
Еквівалентна маса Al (OH) 3 в рівнянні (8):
,
а в рівнянні (9):
.
Приклад. На відновлення 7,09 г оксиду двовалентного металу потрібно 2,24 л водню (н.у.). Обчисліть еквівалентну масу оксиду і еквівалентну масу металу. Чому дорівнює атомна маса металу?
Рішення. Відповідно до закону еквівалентів, маси реагуючих речовин m1 і m2 пропорційні їх еквівалентним масам:
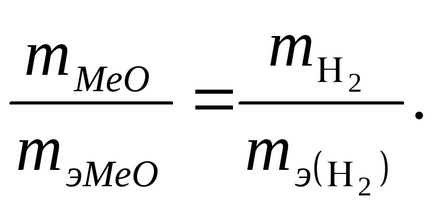
Обчислюють масу виділився водню, знаючи, що при нормальних умовах I моль будь-якого газу займає об'єм 22,4 л: