Хімічна з
каталізаторів має велике значення при промисловому здійсненні каталітичних процесів.
5. При позитивному каталізі каталізатор зменшує енергію активації реакції. Це пов'язано з тим, що енергії активації утворення проміжних комплексів каталізатора з вихідними реагентами і освіти з них продуктів реакції зазвичай значно нижче енергії активації некаталітичного реакції.
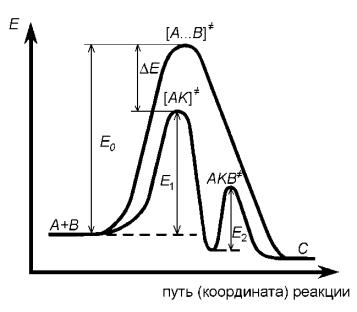
На малюнку (8.1) представлено зміна енергії системи в каталітичної і некаталітичного бімолекулярний реакції
Малюнок - 8.1 Зміна потенційної енергії в гомогенної каталітичної і некаталітичного реакціях
У відсутності каталізатора механізм процесу можна уявити
Зменшення енергії активації відповідає величині E А (зазвичай
З останнього рівняння йдуть деякі важливі висновки:
1. Швидкість реакції пропорційна вихідній концентрації каталізатора С0 До.
2. У загальному випадку порядок реакції буде дробовим.
3. Якщо С A K одно. »1, то υ = k 3 С0 До і реакція стає реакцією нульового порядку по вихідній речовині А. Це означає, що весь каталізатор пов'язаний в проміжний комплекс і швидкість реакції визначається його кількістю.
4. Якщо С A K одно. «1, то υ = k 3 k p C A С0 К. а реакція буде реакцією першого порядку по вихідній речовині А; n A = 1.
Таким чином, порядок реакції змінюється в залежності від концентрації реагенту (вихідної речовини А). Такою особливістю володіють тільки каталітичні реакції.
8.4 Гетерогенний каталіз
Гетерогенний каталіз має винятково велике значення в сучасній хімічній промисловості, за деякими оцінками до 70% хімічних продуктів виробляється з використанням гетерогеннокаталітіческіх процесів. Як приклади можна привести синтез сірчаної кислоти, заснований на каталітичному окисленні оксиду сірки (IV) SO 2 в оксид сірки (VI) SO 3 на платиново-ванадієвих каталізаторів (Pt, V 2 O 5); синтез аміаку з водню і азоту на залізних каталізаторах, промотованих оксидами калію, алюмінію; окислення аміаку в оксиди азоту на платинових каталізаторах (виробництво азотної кислоти) та інші.
Так як при гетерогенному каталізі каталізатор є окремою фазу і каталітичні процеси відбуваються на його поверхні (межі поділу фаз), то величезну роль в протіканні
гетерогенно-каталітичних реакцій відіграють процеси масопереносу. Для них характерні всі ті особливості, які розглядалися під час вивчення гетерогенних хімічних реакцій, тобто процес може лімітувати одній зі стадій і відбувається в дифузійної, кінетичної або перехідною області. В даний час вважається твердо встановленим, що каталітична дія відбувається через стадію хімічної взаємодії реагуючих речовин з поверхнею каталізатора або з окремими її ділянками, які отримали назву активних центрів. Роль активних центрів часто грають виступи і ребра на поверхні кристалічної фази каталізатора, дефекти кристалічної структури і т.д.
У загальному випадку гетерогенно-каталітичні процеси можна умовно розбити на наступні стадії:
1. дифузія вихідних речовин з розчину або газової фази до поверхні каталізатора,
2. адсорбція молекул вихідних речовин на активних центрах каталізатора за рахунок хімічних і електро-статичних сил з утворенням деякого проміжного з'єднання:
3. Активація адсорбованого стану (необхідна для цього енергія є справжня енергія активації процесу):
4. Розпад активованого комплексу з утворенням
адсорбованих продуктів реакції:
5. Десорбція продуктів реакції з поверхні каталізатора.
6. Дифузія продуктів реакції від поверхні каталізатора. Оскільки гетерогенно-каталітичні реакції відбуваються між
адсорбованими на активних центрах молекулами, то в рівняння швидкості таких реакцій входять поверхневі концентрації реагуючих речовин. Так, наприклад, гідрування етилену на мідному каталізаторі відбувається між адсорбованими молекулами етилену і водню:
З 2 Н 4 (АДС.) + Н 2 (АДС.) = С 2 Н 6.
а швидкість цієї реакції пропорційна добутку поверхневих концентрацій:
експериментального факту як отруєння каталізатора надзвичайно малою кількістю отрут, яке може повністю придушити активність каталізатора.
Специфічною особливістю гетерокаталітіческіх процесів є здатність каталізатора до промотування і отруєння.
Промоція - збільшення активності каталізатора в присутності речовин, які самі не є каталізаторами цього процесу (промоторів). Наприклад, для катализируемой металевим нікелем реакції
СО + Н 2 -> СН 4 + Н 2 О
введення в нікелевий каталізатор невеликої домішки церію призводить до різкого зростання активності каталізатора.
Отруєння - різке зниження активності каталізатора в присутності деяких речовин (т. Н. Каталітичних отрут). Наприклад, для реакції синтезу аміаку (каталізатор - губчасте залізо), присутність в реакційній суміші сполук кисню або сірки викликає різке зниження активності залізного каталізатора; в той же час здатність каталізатора адсорбувати вихідні речовини знижується дуже незначно.
Основними сучасними теоріями гетерогенного каталізу є Мультиплетність теорія і теорія активних ансамблів.
Мультиплетність теорія. Відповідно до цієї теорії активний центр це сукупність декількох адсорбційних центрів на поверхні каталізатора. При адсорбції реагуючих молекул на активному центрі утворюється Мультиплетність комплекс, завдяки чому перерозподіляються зв'язку і утворюються продукти реакції. Адсорбція протікає згідно з принципами геометричного і енергетичного відповідності.
Сутність геометричного відповідності полягає в тому, що розташування силових центрів в мультиплеті має відповідати розташуванню атомів в адсорбованих молекулі.
Відповідно до принципу енергетичного відповідності, оптимальний склад каталізатора відповідає умові рівності енергії освіти і руйнування Мультиплетність комплексу. Занадто слабкі і надто сильні взаємодії реагуючих речовин з каталізатором небажані.
Для пояснення цих особливостей гетерогенно-каталітичних процесів Г. Тейлором було висловлено таке припущення: каталитически активною є не вся поверхня каталізатора, а лише деякі еѐ ділянки - т.зв. активні центри. якими можуть бути різні дефекти кристалічної структури каталізатора (наприклад, виступи або западини на поверхні каталізатора). В даний час немає єдиної теорії гетерогенного каталізу. Для металевих каталізаторів була розроблена теорія мультиплетов. Основні положення мультиплетной теорії полягають у наступному:
1. Активний центр каталізатора являє собою сукупність певного числа адсорбційних центрів, розташованих на поверхні каталізатора в геометричному відповідності з будовою молекули, що зазнає перетворення.
2. При адсорбції реагуючих молекул на активному центрі утворюється Мультиплетність комплекс, в результаті чого відбувається перерозподіл зв'язків, що приводить до утворення продуктів реакції.
Теорію мультиплетов називають іноді теорією геометричного подібності активного центру і реагують молекул. Для різних реакцій число адсорбційних центрів (кожен з яких ототожнюється з атомом металу) в активному центрі різному - 2, 3, 4 і т.д. Подібні активні центри називаються відповідно дублет, триплет, квадруплет і т.д. (В загальному випадку мультіплет, чому і зобов'язана теорія своєю назвою).
Теорія активних ансамблів. Відповідно до даної теорією каталітичний процес відбувається на групу атомів, які називаються активним ансамблем. На відміну від мультиплетной теорії, атоми активного ансамблю не є елементами кристалічної решітки каталізатора і можуть вільно мігрувати в межах певної області поверхні каталізатора. Міграція обмежена потенційними бар'єрами, що виникають за рахунок мікроскопічних тріщин, наявності домішок, неоднорідності твердої поверхні.
8.5 Ферментативний каталіз
Виключне значення в гомогенному каталізі займає ферментативний каталіз основа життєдіяльності тварин і рослин. Ферменти складаються або повністю, або в основному з білків.
Ферментативний каталіз - каталітичні реакції, що протікають за участю ферментів - біологічних каталізаторів білкової природи. Ферментативний каталіз має дві характерні риси:
1. Висока активність. на кілька порядків перевищує активність неорганічних каталізаторів, що пояснюється дуже значним зниженням енергії активації процесу ферментами. Так, константа швидкості реакції розкладання перекису водню, що каталізується іонами Fе 2+. становить 56 с -1; константа швидкості цієї ж реакції, що каталізується ферментом каталази, дорівнює 3,5 · 10 7. тобто
Тут До m - константа Міхаеліса. чисельно рівна концентрації субстрату при υ = ½ υ max. Константа Міхаеліса є мірою спорідненості між субстратом і ферментом: чим менше До m. тим більше їх здатність до утворення фермент-субстратного комплексу.

Малюнок - 8.5 Залежність швидкості ферментативної реакції від концентрації субстрату
Характерною особливістю дії ферментів є також висока чутливість активності ферментів до зовнішніх умов -
рН середовища і температурі. Ферменти активні лише в досить вузькому інтервалі рН і температури, причому для ферментів характерна наявність в цьому інтервалі максимуму активності при деякому оптимальному значенні рН або температури; по обидві сторони від цього значення активність ферментів швидко знижується.
Для опису кінетики ферментативних реакцій використовують
рівняння Міхаеліса Ментена (8.20).
Розглянемо висновок кінетичного рівняння для гомогенного каталітичного процесу на прикладі реакції з одним вихідним речовиною (субстратом) S. яке перетворюється в продукт P в присутності каталізатора К (зокрема, таким каталізатором може бути фермент):
Фізичний зміст цього рівняння полягає в тому, що при великих концентраціях вихідної речовини весь каталізатор входить до складу проміжного з'єднання КS. Концентрація КS досягає
граничного значення C K 0. Отже, і швидкість отримання
продукту досягає граничної для даної кількості каталізатора величини, що позначається υ max.

Лабораторна робота №1
Вивчення швидкості інверсії тростинного цукру
Мета роботи: вивчити швидкість інверсії тростинного цукру і обчислити константу швидкості реакції інверсії.
Інверсія тростинного цукру є кислотно-каталізуються реакцією гідролізу сахарози, в результаті якої виходять прості цукри: глюкоза і фруктоза. Дана реакція широко використовується в промисловому виробництві. Рівняння реакції має вигляд:
Дана реакція є практично незворотною, і за своїм механізмом, як видно з рівняння, є бімолекулярний. Отже, еѐ швидкість може бути розрахована по кінетичного рівняння:
Однак реакція протікає у водному розчині, де концентрація води значно перевищує концентрацію сахарози. Тому спадом молекул води в ході реакції можна знехтувати і вважати концентрацію води постійною. тоді
тобто реакція є бімолекулярний, фактично описується кінетичним рівнянням реакції першого порядку. Такі реакції називаються реакціями nсевдоnервого порядку, а константа швидкості може бути розрахована за рівнянням
Молекули всіх цукрів, в тому числі і сахарози, глюкози і фруктози містять асиметричний атом вуглецю, що обумовлює їх оптичну активність і здатність обертати площину поляризації