Гормони - гормональна регуляція вуглеводного, ліпідного, білкового та водно-сольового обміну -
Сторінка 7 з 9
Гормональна регуляція вуглеводного, ліпідного, білкового та водно-сольового обміну
Основні енергетичні ресурси живого організму - вуглеводи і жири володіють високим запасом потенційної енергії, легко витягується з них в клітинах за допомогою ферментних катаболічних перетворень. Енергія, що вивільняється в процесі біологічного окислення продуктів вуглеводного і жирового обмінів, а також гліколізу, перетворюється в значній мірі в хімічну енергію фосфатних зв'язків синтезованого АТФ. Акумульована ж в АТФ хімічна енергія макроергічних зв'язків, в свою чергу, витрачається на різного виду клітинну роботу - створення і підтримання електрохімічних градієнтів, скорочення м'язів, секреторні і деякі транспортні процеси, біосинтез білка, жирних кислот і т.д. Крім «паливної» функції вуглеводи і жири поряд з білками виконують роль важливих постачальників будівельних, пластичних матеріалів, що входять в основні структури клітини, - нуклеїнових кислот, простих білків, глікопротеїнів, ряду ліпідів і т.д. Синтезируемая завдяки розпаду вуглеводів і жирів АТФ не тільки забезпечує клітини необхідною для роботи енергією, але і є джерелом утворення цАМФ, а також бере участь в регуляції активності багатьох ферментів, стану структурних білків, забезпечуючи їх фосфорилювання.
Вуглеводними і ліпідними субстратами, безпосередньо утилізованих клітинами, є моносахариди (перш за все глюкоза) і неестеріфіцірованних жирні кислоти (НЕЖК), а також в деяких тканинах кетонові тіла. Їх джерелами служать харчові продукти, всмоктується з кишечника, депоновані в органах у формі глікогену вуглеводів і в формі нейтральних жирів ліпіди, а також невуглеводної попередники, в основному амінокислоти і гліцерин, що утворюють вуглеводи (глюконеогенез). До депонують органам у хребетних відносятьсяпечінка і жирова (адіпозних) тканину, до органів глюконеогенезу - печінку і нирки. У комах депонують органом є жирове тіло. Крім цього, джерелами глюкози і НЕЖК можуть бути і деякі запасні або інші продукти, що зберігаються або утворюються в працюючій клітці. Різні шляхи і стадії вуглеводного і жирового обмінів взаємопов'язані численними взаємовпливами. Напрямок та інтенсивність перебігу цих обмінних процесів знаходяться в залежності від ряду зовнішніх і внутрішніх факторів. До них відносяться, зокрема, кількість і якість споживаної їжі і ритми її надходження в організм, рівень м'язової і нервової діяльності і т.д.
Тваринний організм адаптується до характеру харчового режиму, до нервової або м'язової навантаженні за допомогою складного комплексу координуючих механізмів. Так, контроль перебігу різних реакцій вуглеводного і ліпідного обмінів здійснюється на рівні клітини концентраціями відповідних субстратів і ферментів, а також ступенем накопичення продуктів тієї чи іншої реакції. Ці контролюючі механізми відносяться до механізмів саморегуляції і реалізуються як в одноклітинних, так і в багатоклітинних організмах. У останніх регуляція утилізації вуглеводів і жирів може відбуватися на рівні міжклітинних взаємодій. Зокрема, обидва види обміну реципрокно взаємоконтролюючі: НЕЖК в м'язах гальмують розпад глюкози, продукти ж розпаду глюкози в жировій тканині гальмують утворення НЕЖК. У найбільш високоорганізованих тварин з'являється особливий міжклітинний механізм регуляції проміжного обміну, визначається виникненням в процесі еволюції ендокринної системи, що має першорядне значення в контролі метаболічних процесів цілого організму.
Серед гормонів, що беруть участь в регуляції жирового і вуглеводного обмінів у хребетних, центральне місце займають наступні: гормони шлунково-кишкового тракту, які контролюють перетравлення їжі та всмоктування продуктів травлення в кров; інсулін і глюкагон - специфічні регулятори проміжного обміну вуглеводів і ліпідів; СТГ і функціонально пов'язані з ним «Соматомедин» і СІФ, глюкокортикоїди, АКТГ і адреналін - фактори неспецифічної адаптації. Слід зазначити, що багато названі гормони приймають також безпосередню участь і в регуляції білкового обміну (див. Гл. 9). Швидкість секреції згаданих гормонів і реалізація їх ефектів на тканині взаємопов'язані.
Ми не можемо спеціально зупинятися на функціонуванні гормональних чинників шлунково-кишкового тракту, секретується в нервово-гуморальну фазу сокоотделения. Їх головні ефекти добре відомі з курсу загальної фізіології людини і тварин і, крім того, про них вже досить повно згадувалося в гл. 3. Більш детально зупинимося на ендокринної регуляції проміжного метаболізму вуглеводів і жирів.
Гормони і регуляція проміжного вуглеводного обміну. Інтегральним показником балансу обміну вуглеводів в організмі хребетних є концентрація глюкози в крові. Цей показник стабільний і становить у ссавців приблизно 100 мг% (5 ммоль / л). Його відхилення в нормі зазвичай не перевищують ± 30%. Рівень глюкози в крові залежить, з одного боку, від припливу моносахарида в кров переважно з кишечника, печінки і нирок і, з іншого - від його відтоку в працюючі і депонують тканини (рис. 2).
Приплив глюкози з печінки і нирок визначається співвідношенням активностей глікогенфосфорілазной і глікогенсінтетазной реакції в печінці, співвідношенням інтенсивності розпаду глюкози і інтенсивності глюконеогенезу в печінці і частково в нирці. Надходження глюкози в кров прямо корелює з рівнями фосфорілазной реакції і процесів глюконеогенезу. Відтік глюкози з крові в тканини знаходиться в прямій залежності від швидкості її транспорту в м'язові, адіпозних і лімфоїдні клітини, мембрани яких створюють бар'єр для проникнення в них глюкози (нагадаємо, що мембрани клітин печінки, мозку і нирок легко проникні для моносахарида); метаболічної утилізації глюкози, в свою чергу залежної від проникності до неї мембран і від активності ключових ферментів її розпаду; перетворення глюкози в глікоген в печінкових клітинах (Левін та ін. 1955; Ньюсхолм, Рендл, 1964; Фоа, 1972). Всі ці процеси, пов'язані з транспортом і метаболізмом глюкози, безпосередньо контролюються комплексом гормональних чинників.
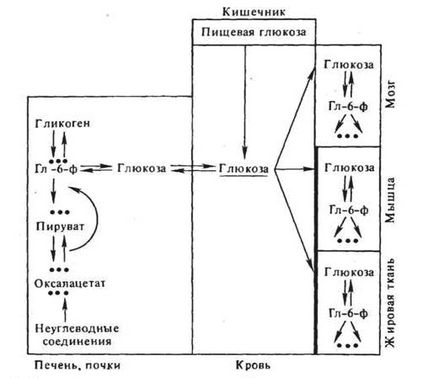
Рис.2. Шляхи підтримки динамічного балансу глюкози в крові Мембрани м'язових і адіпозних клітин мають "бар'єр" для транспорту глюкози; Гл-б-ф - глюкозо-б-фосфат
Гормональні регулятори вуглеводного обміну за дією на загальний напрямок обміну і рівень глікемії можуть бути умовно розділені на два типи. Перший тип гормонів стимулює утилізацію глюкози тканинами і її депонування в формі глікогену, але гальмує глюконеогенез, і, отже, викликає зниження концентрації глюкози в крові. Гормоном такого типу дії є інсулін. Другий тип гормонів стимулює розпад глікогену і глюконеогенез, а отже, викликає підвищення вмісту глюкози в крові. До гормонів цього типу відносяться глюкагон (а також секретин і ВІП) і адреналін. Гормони третього типу стимулюють глюконеогенез в печінці, гальмують утилізацію глюкози різними клітинами і, хоча підсилюють утворення глікогену гепатоцитами, в результаті переважання перших двох ефектів, як правило, також підвищують рівень глюкози в крові. До гормонів даного типу можна віднести глюкокортикоїди і СТГ - «Соматомедин». Разом з тим, володіючи односпрямованим дією на процеси глюконеогенезу, синтезу глікогену і гліколізу, глюкокортикоїди і СТГ - «Соматомедин» по-різному впливають на проникність мембран клітин м'язової та адипозной тканини до глюкози.
По спрямованості дії на концентрацію глюкози в крові інсулін є гипогликемическим гормоном (гормон «спокою і насичення»), гормони ж другого і третього типів - гипергликемической (гормони «стресу і голодування»)
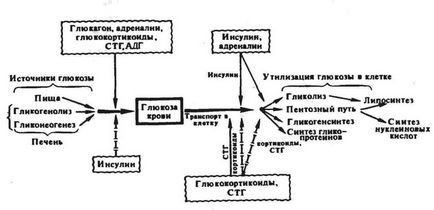
Рис 3. Гормональна регуляція вуглеводного гомеостазу: суцільними стрілками позначена стимуляція ефекту, пунктирними - гальмування
Інсулін можна назвати гормоном засвоєння і депонування вуглеводів. Однією з причин посилення утилізації глюкози в тканинах є стимуляція гліколізу. Вона здійснюється, можливо, на рівні активації ключових ферментів гліколізу гексокінази, особливо однієї з чотирьох відомих її ізоформ - гексокінази П, і глюкокинази (Вебер, 1966; Ільїн, 1966, 1968). Мабуть, певну роль в стимуляції катаболізму глюкози інсуліном грає і прискорення пентозофосфатного шляху на стадії глюкозо-6-фосфатдегідрогеназной реакції (Лейтес, Лаптєва, 1967). Вважається, що в стимуляції захоплення глюкози печінкою при харчової гіперглікемії під впливом інсуліну найважливішу роль відіграє гормональна індукція специфічного печінкового ферменту глюкокинази, вибірково фосфорилювання глюкозу при високих її концентраціях.
Головна причина стимуляції утилізації глюкози м'язовими і жировими клітинами - перш за все виборче підвищення проникності клітинних мембран до моносахариду (Лунсгаард, 1939; Левін, 1950). Таким шляхом досягається підвищення концентрації субстратів для гексокіназну реакції і пентозофосфатного шляху.
Посилення гліколізу під впливом інсуліну в скелетних м'язах і міокарді грає істотну роль в накопиченні АТФ і забезпеченні працездатності м'язових клітин. У печінки посилення гліколізу, мабуть, важливо не стільки для підвищення включення пірувату в систему тканинного дихання, скільки для накопичення ацетил-КоА і Малоні-КоА як попередників освіти багатоатомних жирних кислот, а отже, і три-гліцеридів (Ньюсхолм, Старт, 1973). Утворений в процесі гліколізу гліцерофосфат також включається в синтез нейтрального жиру. Крім того, і в печінці, і особливо в адипозной тканини для підвищення рівня липогенеза з глюкози істотну роль грає стимуляція гормоном глюкозо-б-фосфатдегідрогеназной реакції, що призводить до утворення НАДФН - відновлює кофактора, необхідного для біосинтезу жирних кислот і гліцерофосфату. При цьому у ссавців тільки 3-5% всмоктується глюкози перетворюється в печінкової глікоген, а більше 30% накопичується у вигляді жиру, відкладали в депонуються органах.
Таким чином, основний напрямок дії інсуліну на гліколіз і пентозофосфатний шлях в печінці і особливо в жировій клітковині зводиться до забезпечення освіти тригліцеридів. У ссавців і птахів в адипоцитах, а у нижчих хребетних в гепатоцитах глюкоза - один з головних джерел депонуються тригліцеридів. В даних випадках фізіологічний сенс гормональної стимуляції утилізації вуглеводів зводиться значною мірою до стимуляції депонування ліпідів. Одночасно з цим інсулін безпосередньо впливає на синтез глікогену - депонованої форми вуглеводів - не тільки в печінці, але і в м'язах, нирці, і, можливо, жирової тканини.
Адреналін за впливом на вуглеводний обмін близький до глюкагону, оскільки механізмом медіації їх ефектів є аденілатціклазную комплекс (Робізон і ін. 1971). Адреналін, як і глюкагон, посилює розпад глікогену і процеси глюконеогенезу. У фізіологічних концентраціях глюкагон переважно рецептіруется печінкою і адипозной тканиною, а адреналін - м'язами (перш за все міокардом) і жировою тканиною. Тому для глюкагону в більшій, а для адреналіну в меншій мірі характерні відставлена під час стимуляція глюконеогенетіческіх процесів. Однак ж для адреналіну в значно більшому ступені, ніж для глюкагону, типово підвищення глікогенолізу і, мабуть, внаслідок цього гліколізу і дихання в м'язах. У плані не механізмів, а загального впливу на гликолитические процеси в м'язових клітинах адреналін є частково сінерегістом інсуліну, а не глюкагону. Мабуть, інсулін і глюкагон в більшій мірі - гормони харчування, а адреналін - стресорні гормон.
В даний час встановлено ряд біохімічних механізмів, що лежать в основі дії гормонів на ліпідний обмін.
Інсулін надає протилежне адреналіну і глюкагону дію на ліполіз і мобілізацію жирних кислот. Нещодавно було показано, що інсулін стимулює фосфодіестеразную активність в жировій тканині. Фосфодіестерази грає важливу роль в підтримці постійного рівня цАМФ в тканинах, тому збільшення вмісту інсуліну повинно підвищувати активність фосфодіестерази, що в свою чергу призводить до зменшення концентрації цАМФ в клітці, а отже, і до утворення активної форми ліпази.
Безсумнівно, і інші гормони, зокрема тироксин, статеві гормони, також впливають на ліпідний обмін. Наприклад, відомо, що видалення статевих залоз (кастрація) викликає у тварин надлишкове відкладення жиру. Однак відомості, які ми маємо, не дають поки підстави з упевненістю говорити про конкретний механізм їх дії на обмін ліпідів.
В гормональної регуляції обміну білків беруть участь гормони щитовидної залози тироксин (Т3) посилює синтез білків; Високі концентрації Т3 навпаки, пригнічують синтез білка; гормон росту, інсулін тестостерон, естроген підсилюють розпад білків, особливо в м'язової і лімфоїдної тканини, але стимулюють синтез білків в печінці.
Регуляція водно-сольового обміну відбувається нервово-гормональних шляхом. При зміні осмотической концентрації крові порушуються спеціальні чутливі утворення (осморецептори), інформація від яких передається в центр, нервову систему, а від неї до задньої долі Гіпофіза. При підвищенні осмотической концентрації крові збільшується виділення антидіуретичного гормону, який зменшує виділення води з сечею; при надлишку води в організмі знижується секреція цього гормону і посилюється її виділення нирками. Постійність об'єму рідин тіла забезпечується особливою системою регуляції, рецептори якої реагують на зміну кровонаповнення великих судин, порожнин серця та ін .; в результаті рефлекторно стимулюється секреція гормонів, під впливом яких нирки змінюють виділення води і солей натрію з організму. Найбільш важливі в регуляції обміну води гормони вазопресин і глюкокортикоїди, натрію - альдостерон і ангіотензин, кальцію - Паратиреоїдний гормон і кальцитонін.