Енергія атомізації ковалентних кристалів
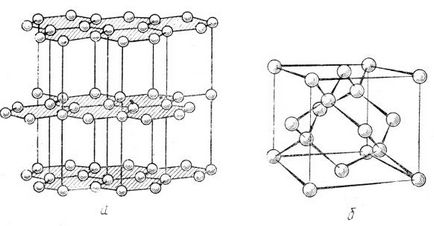
Мал. 37. Структура графіту (а), структура алмазу (б)
Графітоподібний структура (див. Рис. 37 а) характерна і для нітриду бору BN, який при високому тиску переходить в кубічну алмазоподобную структуру типу сфалериту (рис. 37 б), тетраедричну оточення кожного з атомів якої вказує на їх sp 3 - гібридизації. Сказане підтверджує, що sp 2 - і sp 3 - гібридні орбіталі не є винятковою приналежністю атомів IV групи, вони можливі і для сусідніх атомів III і V груп.
Енергія зчеплення атомів, пов'язаних ковалентними силами, вимірюється в процесі дисоціації молекули або сублімації кристала з утворенням одноатомного газу. Тому енергію зчеплення ковалентного кристала можна назвати енергією атомізації. щоб відрізняти її від енергії іонної решітки, яка виділяється при утворенні кристала з газу іонів.
Проблема теоретичного розрахунку енергії ковалентного зв'язку дуже складна, так як вона стикається з труднощами вирішення квантово-механічної задачі багатьох частинок. Тому до цих пір досить поширеними залишаються різні емпіричні методи оцінки енергії ковалентного зв'язку. Досвід показує, що рівноважна енергія ординарної гомополярной зв'язку знаходиться в досить простий лінійної залежності від її довжини. Цю залежність можна виразити наближеним рівнянням: E (ккал) = - 38 R (Å) +136. Для елементів IV групи (С, Si, Ge, Sn) вільний
член в такому рівнянні дещо більше: E (ккал) = - 38 R (Å) +143.
Енергія кратному зв'язку зазвичай не є простим твором енергії ординарної зв'язку і кратності. Наприклад, енергія розриву ординарної зв'язку С - С
становить 84, подвійний - 141, а потрійний - 187 ккал. Можна бачити, що π-зв'язку помітно слабкіше σ-зв'язку, причому друга π-зв'язок слабкіше першої. Ослаблення π-зв'язку компенсується укорочением кратного зв'язку в порівнянні з простою σ -зв'язком. Так, енергії ординарної, подвійною і потрійною зв'язків між С і N складають 73, 142 і 210 ккал / моль, т. Е. Перебувають у відношенні приблизно 1: 2: 3 в зв'язку з укороченням довжини зв'язку в цьому ряду на 0,35 Å .
Енергії ковалентних взаємодій між різними елементами зазвичай оцінюються по постулату Полінга про среднеарифметическом:
Можна відзначити, що за допомогою напівемпіричних методу молекулярних орбіталей було знайдено виправдання наближеного рівності (12), а завдяки його простоті воно практично дуже зручно. Так, наприклад, енергія ковалентного взаємодії між Li і S буде дорівнює E (Li-S) = 1/2 (28 + 55) = 48 ккал.
5. ЗВ'ЯЗКУ, ПРОМІЖНІ МІЖ іонними І ковалентних. РІВЕНЬ ионности ЗВ'ЯЗКУ.
Електронегативність і ступінь ионности.
Для того щоб охопити всі можливі переходи між гранично іонної і гранично ковалентного зв'язками, Л. Полінг ввів в 1932 р поняття
електронегативності атома і ступеня ионности ε хімічного зв'язку, яка може змінюватися від 1 або 100% для іонної зв'язку до 0 - для ковалентного. Електронегативність характеризують здатність атома в молекулі (кристалі) притягувати до себе електрони. З цього вельми загального визначення випливає, що чим більше ЕО деякого елемента, тим сильніше він утримує загальну електронну пару зв'язку в своїй оболонці. Легко зрозуміти, що значення ЕО повинні бути найбільшими для таких елементів, як галогени (F, Cl і ін.) І кисень, а найменшими - для лужних металів (Cs, Rb, K та ін.).
Полінг побудував шкалу ЕО, вибравши довільну точку відліку таким чином,
щоб ЕО елементів другого періоду від Li до F знаходилися в діапазоні від 1,0 до 4,0. Значення ЕО наведені в Додатку 1-8.
Між ЕО Полінга χ П і орбітальної ЕО Маллікен χ М існує
наближена пропорційність: χ М / χ П 2,8 еВ. наприклад:
де значення параметра α становить близько 0,2. Тут ε - ступінь ионности, а ξ -
ступінь ковалентності (гомеополярной) зв'язку. Рівняння (13) відображає той факт, що при збільшенні різниці ЕО Δ χ зростає ступінь ионности зв'язку.
Рівняння (13) можна застосувати і для істотно ковалентних кристалів, в яких перше координаційне число збігається з формальної валентності, т. Е. На кожного зв'язку локалізується електронна пара. Наприклад, в BN з шаруватою структурою типу графіту КЧ = 3, як і валентності В і N. Тоді отримаємо наступну оцінку ионности зв'язку в цьому кристалі:
ε (BN) = l -exp [-0,2 (3,0 - 2,0) 2] = l - exp (-0,2) = 0,18.
Іншими словами, зв'язок в BN зі структурою графіту має 18% іонного характеру.
Однак в більш іонних кристалах КЧ зазвичай більше формальної валентності і електронні пари делокалізованних. Для подібних випадків рівняння (13) дає лише нижню межу ступеня ионности зв'язку. Як припустив Полінг, ступінь делокалізації пропорційна міцності (або кратності) зв'язку s = z / ν. де z -
валентність, а ν - координаційне число. Тоді рівняння (13) приймає вигляд:
ε '(AB) = 1 ξ = 1 (z / ν) exp [- α (Δ χ) 2].
Наприклад, що для кристала BN зі структурою типу алмазу і тетраедричних оточеннями обох атомів, який може бути отриманий з шаруватої модифікації при високому тиску, s = 3/4 і ε = 0,38. Для молекули LiF КЧ = 1 і ε = 0,83 (13), а для
кристала КЧ = 6, s = 1/6 і ε '= 0,97 (14).
Зв'язок енергії атомізації і енергії решітки кристалів.
Можна без праці якісно визначити зміна (зростання або зменшення) ступеня ионности зв'язку в рядах сполук з одним загальним атомом, наприклад в ряду MX при заміні тільки М (або тільки X). Тоді, очевидно, ступінь ионности буде тим менше, чим більше ЕО (М) або чим вище потенціал іонізації I (М).
Відзначимо, що для всіх кристалів, крім галогенідів і гідридів, через відсутність спорідненості до двох електронів для O, S і інших аніонів, експериментально можна визначити тільки енергію атомізації Е. яка виділяється при утворенні кристала з газу атомів, відповідно до термохимическим циклом :
E = Δ H f + Σ Δ H ат.
Можна бачити, що різниця між енергією решітки і енергією атомізації дорівнює алгебраїчній сумі потенціалів іонізації і спорідненості до електрону всіх атомів в кристалі.
6. зонна ЕНЕРГЕТИЧНА СТРУКТУРА КРИСТАЛА: діелектриком, НАПІВПРОВІДНИКИ І МЕТАЛИ.
Будова таких молекул, як Li 2. Na 2 і ін. Дуже схоже на будову молекули
H 2. σ-зв'язок між атомами здійснюється завдяки перекривання s -орбіталей атомів. Інше становище виникає при конденсації таких молекул і утворенні кристала. Результатом є поява великої кількості багатоцентрових орбіталей, які захоплюють весь кристал і дискретні рівні, на яких розташовуються електрони в ізольованих атомах, при утворенні кристала розпливаються в цілу енергетичну зону, як показано на рис. 36. Внутрішні електрони атомів майже не взаємодіють, їх остови мало перекриваються, і відповідна зона слабо розщеплюється. Тому внутрішні електрони атомів залишаються локалізованими у своїх ядер (крива 4). Валентні електрони, навпаки,
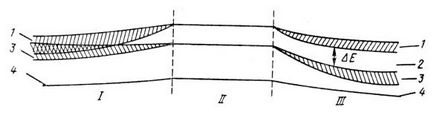
сильно взаємодіють, і відповідні енергетичні рівні займають широку смугу - валентну зону (крива 3). Над нею знаходиться зона, яка може бути потенційно зайнята електронами і утворюється з сукупності несвязивающіх орбіталей, - зона провідності (крива 1).
Мал. 38. Схема взаємного розташування енергетичних зон: I - металу, III - напівпровідника і діелектрика; 1 - зона провідності, 2 - заборонена зона, 3 - валентна зона, 4 - внутрішній рівень. II - рівні ізольованого атома, Δ E - ширина забороненої зони (2).
Якщо між ними існує енергетична щілину, не зайнята електронами, то вона називається забороненою зоною. Її ширина позначається E g (або Δ E); вона позначена цифрою 2 на рис. 36.
Валентна зона не перекривається із зоною провідності, коли величина E g
істотно більше теплової енергії (при кімнатній температурі ≈ 0,1 еВ). Цьому нагоди відповідає освіту діелектриків і напівпровідників. Типові діелектрики є як серед іонних кристалів, наприклад LiF і CaF 2 (Δ E = 12 еВ), так і серед ковалентних кристалів, наприклад алмаз (Δ E = 5,3 еВ).
Типові напівпровідники - кристали зі структурами типу алмаза-сфалериту: Ge (0,75), Si (1,12), AlSb (1,60), CdS (2,3 еВ). На кордоні між напівпровідниками і діелектриками знаходиться карбід кремнію SiC (3 еВ). У розглянутих випадках валентна зона кристала зайнята повністю. Наприклад, в разі іонного діелектрика (LiF, CaF 2. MgO, NaСl і ін.) Валентна зона заповнена електронами, локалізованими на аніони, а порожня зона провідності пов'язана з вакантними орбиталями катіонів. У алмазі і напівпровідниках з подібною йому структурою валентна зона повністю зайнята електронами, які можна розглядати як локалізовані на двухелектронних зв'язках, утворених спрямованими гібридними sp 3 -орбіталей сусідніх атомів. Тепер стає зрозумілим, чому все ковалентні тверді тіла, що підкоряються правилу Юм-Розера kч = 8 - N. не можуть бути провідниками. Дійсно, якщо виконується це правило, кожен атом отримує можливість