Електроліти та їх властивості - хімія
Читати далі: Сильні електроліти. активність іонів
Водні розчини солей, кислот і підстав володіють певною особливістю - вони проводять електричний струм. При цьому безводні тверді солі і підстави, а також безводні кислоти струму не проводять; майже не проводить струму і чиста вода. Очевидно, що при розчиненні у воді подібні речовини піддаються якимось глибокі зміни, які і обумовлюють електропровідність одержуваних розчинів.
Наприклад, при проходженні струму через розчин сірчаної кислоти, відбувається розкладання води на складові частини - водень і кисень, що виділяються на пластинах, з'єднаних відповідно з негативним і позитивним полюсами батареї. Такого роду розчини, що розкладаються хімічно при проходженні через них струму, будемо називати електролітами, а сам процес розкладання речовини електричним струмом - електролізом.
1. Визначення електролітів
Можна сказати, що електроліти - це речовини, в яких в помітною концентрації присутні іони, що зумовлюють проходження електричного струму (іонну провідність). Електроліти також мають назву провідників другого роду.
У вузькому сенсі слова електроліти - речовини, молекули яких в розчині, внаслідок електролітичноїдисоціації, розпадаються на іони. Серед електролітів розрізняють тверді, розчини електролітів і іонні розплави. Розчини електролітів часто також називають електроліти. Залежно від виду розчинника електроліти діляться на водні і електроліти неводні. До особливого класу відносяться високомолекулярні електроліти - поліелектроліти.
У відповідності з природою іонів, що утворюються при електролітичноїдисоціації водних розчинів, виділяють сольові електроліти (в них відсутні іони Н + і ОН -), кислоти (переважають іони Н +) і підстави (переважають іони ОН -). Якщо при дисоціації молекул електролітів число катіонів збігається з числом аніонів, то такі електроліти називають симетричними (1,1 -валентнимі, наприклад, КСl, 2,2-валентними, наприклад, CaSO4. І т.д.). В іншому випадку електроліти називають несиметричними (1,2-валентні електроліти, напр. H2 SO4. 3,1-валентні, наприклад, А1 (ОН) 3. І т.д.). Залежно від здатності до електролітичноїдисоціації електроліти умовно поділяють на сильні і слабкі. Слабкі електроліти характеризуються, перш за все, константою і ступенем дисоціації, а сильні активністю іонів.
1.1 Слабкі електроліти. Константа та ступінь дисоціації
Молекули слабких електролітів лише частково диссоційовані на іони, які знаходяться в динамічній рівновазі з недіссоціірующімі молекулами. До слабких електролітів належать багато органічні кислоти і підстави у водних і неводних розчинниках. Ступінь дисоціації залежить від природи розчинника, концентрації розчину, температури та інших факторів ( <1). Один и тот же электролит при одинаковой концентрации, но в различных растворителях образует растворы с различной степенью диссоциации.
У розчинах слабких електролітів встановлюється рівновага між недіссоціірованнимі молекулами і продуктами їх дисоціації - іонами. Наприклад, у водному розчині оцтової кислоти встановлюється рівновага
СНзСООН Н + + СН 3 СОО -
Константа якого (константа дисоціації) пов'язана з концентраціями відповідних часток співвідношенням:
Ступенем дисоціації а електроліту називається частка його молекул, що піддалися дисоціації, т. Е. Ставлення числа молекул, що розпалися в цьому розчині на іони, до загального числа молекул електроліту в розчині.
У разі електроліту MX, дисоціюють на іони М + і Х-, константа і ступінь дисоціації пов'язані співвідношенням (закон розведення Оствальда)
де С - молярна концентрація електроліту, моль / л.
Якщо ступінь дисоціації значно менше одиниці, то при наближених обчисленнях можна прийняти, що 1 - а1. Тоді вираз закону розведення спрощується:
Останнє співвідношення показує, що при розведенні розчину (т. Е. При зменшенні концентрації електроліту С) ступінь дисоціації електроліту зростає.
Якщо в розчині електроліту MX ступінь його дисоціації рівна а, то концентрації іонів М + і Х- в розчині однакові і складають:
Підставивши сюди значення а з попереднього співвідношення, знаходимо:
Для розрахунків, пов'язаних з дисоціацією кислот, часто зручно користуватися не константою К, а так званим показником константи дисоціації рК, який визначається співвідношенням
Очевидно, що зі зростанням До, т. Е. Зі збільшенням сили кислоти, значення рК зменшується; отже, чим більше рК, тим слабкіше кислота.
При введенні в розчин слабкого електроліту однойменних іонів (т. Е. Іонів, однакових з одним з іонів, що утворюються при дисоціації електроліту) рівновага дисоціації порушується і зміщується в напрямку освіти недіссоціірованних молекул, так що ступінь дисоціації електроліту зменшується. Так, додаток до розчину оцтової кислоти її солі (наприклад, ацетату натрію) призведе до підвищення концентрації іонів СН3 СОО - і, відповідно до принципу Ле Шательє, рівновага дисоціації зміститься вліво.
СНзСООН Н + + СН 3 СОО -
У розчинах многоосновних кислот, а також підстав, що містять кілька гідроксильних груп, встановлюються ступінчасті рівноваги, що відповідають послідовним стадіям дисоціації. Так, дисоціація ортофосфорної кислоти протікає в три ступені, кожній з яких відповідає певне значення ступінчастою константи дисоціації. Оскільки К1 >> К2 >> К3. то найбільшою мірою протікає дисоціація по першій ступені, а при переході до кожної наступної стадії ступінь дисоціації, як правило, різко зменшується.
Дисоціація електроліту призводить до того, що загальне число частинок розчиненої речовини (молекул і іонів) в розчині зростає в порівнянні з розчином неелектроліту тієї ж молярної концентрації. Тому властивості, що залежать від загального числа що знаходяться в розчині частинок розчиненої речовини (Колігативні властивості), - такі, як осмотичний тиск, зниження тиску пара, підвищення температури кипіння, зниження температури замерзання - проявляються в розчинах електролітів в більшій мірі, ніж в рівних по концентрації розчинах неелектролітів. Якщо в результаті дисоціації загальне число частинок в розчині електроліту зросло в i разів в порівнянні з числом його молекул, то це повинно бути враховано при розрахунку осмотичного тиску та інших Колігативні властивостей. Формула для обчислення зниження тиску # 8710; р пара розчинника набуває в цьому випадку такий вигляд:
р0 - тиск насиченої пари над чистим розчинником;
п2 - число молей розчиненої речовини;
п1 - число молей розчинника;
i - ізотонічний коефіцієнт або коефіцієнт Вант-Гоффа.
Аналогічно зниження температури кристалізації # 8710; tкріст і підвищення температури кипіння # 8710; t кип розчину електроліту знаходять за формулами
де m - моляльна концентрація електроліту, а К і Е - відповідно, кріоскопічна постійна і ебулліоскопіческая постійна розчинника.
Нарешті, для обчислення осмотичного тиску (Р, кПа) розчину електроліту використовують формулу
де С - молярна концентрація електроліту, моль / л; R - газова постійна (8,31 Дж. Моль -1. До -1); Т - абсолютна температура, К.
Неважко бачити, що ізотонічний коефіцієнт i може бути обчислений як відношення # 8710; р. # 8710; tкріст. # 8710; t кип. Р, знайдених на досвіді, до тих же величинам, обчисленими без урахування дисоціації електроліту (# 8710; рвич. # 8710; tкріст.вич, # 8710; tкіп.вич, Рвич):
Ізотонічний коефіцієнт i пов'язаний зі ступенем дисоціації електроліту а співвідношенням
де k - число іонів, на які розпадається при дисоціації молекула електроліту (для КСl k = 2, для ВаСl2 і Na2 SO4 k = 3 і т. д.).
Таким чином, знайшовши по досвідченим величинам # 8710; р, # 8710; tкріст і т. П. Значення i, можна обчислити ступінь дисоціації електроліту в даному розчині. При цьому слід мати на увазі, що в разі сильних електролітів знайдене таким способом значення а висловлює лише «уявну» ступінь дисоціації, оскільки в розчинах сильні електроліти дисоційований повністю. Спостережуване відміну уявній ступеня дисоціації від одиниці пов'язано з межіоннимі взаємодіями в розчині.
Читати далі: Сильні електроліти. активність іонів
Інформація про роботу «Електроліти і їх властивості»
Розділ: Хімія
Кількість знаків з пробілами: 73378
Кількість таблиць: 4
Кількість зображень: 1
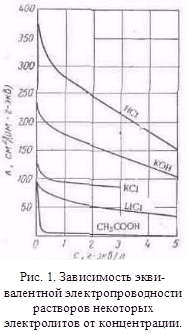
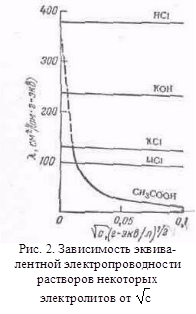
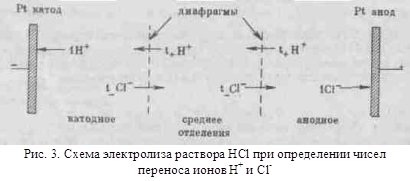
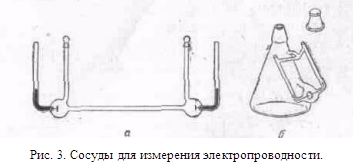
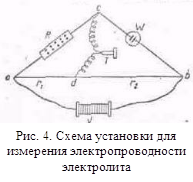
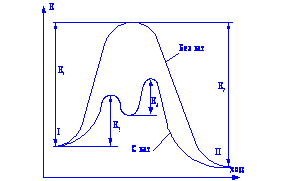
з іншими розчинниками рассмот-ренние закономірності зберігаються, але є і відступу від них, наприклад на кривих # 955; -з часто спостерігається мінімум (аномальна електропровідність). 2. Рухливість іонів Зв'яжемо електропровідність електроліту зі швидкістю руху-ня його іонів в електричному полі. Для обчислення Електроприв-водності досить підрахувати число іонів.
з киснем, відновленням - відібрання кисню. З введенням в хімію електронних уявлень поняття окисно-відновних реакцій було поширене на реакції, в яких кисень не бере. У неорганічної хімії окислювально-відновні реакції (ОВР) формально можуть розглядатися як переміщення електронів від атома одного реагенту (відновника) до атому іншого (.
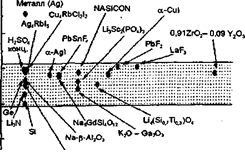
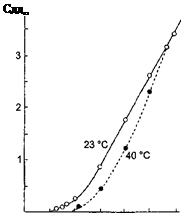
при вивченні синтезу нових матеріалів і процесів іонного транспорту в них. У чистому вигляді такі закономірності найбільш чітко простежуються при дослідженні монокристалічних твердих електролітів. У той же час при використанні твердих електролітів в якості робочих середовищ функціональних елементів необхідно враховувати, що потрібні матеріали заданого виду і форми, наприклад у вигляді щільної кераміки.
17-25 кг / т алюмінію-ня, що на
10-15 кг / т вище в порівнянні з результатами для пес-чаного глинозему. У глиноземі, використовуваному для виробництва алюмінію, має міститися мінімальна кількість сполук заліза, кремнію, важких металів з меншим потенціалом виділення на катоді, ніж алюміній, тому що вони легко відновлюються і перехо-дять в катодний алюміній. Небажано також присутність в.