дисоціація води
Чиста вода дуже погано проводить електричний струм, але все ж має вимірної електропровідністю, яка пояснюється частковою дисоціацією молекул Н2 О на іони водню і гідроксид-іони:
За величиною електропровідності чистої води можна обчислити концентрацію в ній іонів Н + і ОН -. При 25 о С вона дорівнює 10 -7 моль / л.
Константа дисоціації Н2 Про розраховується наступним чином:
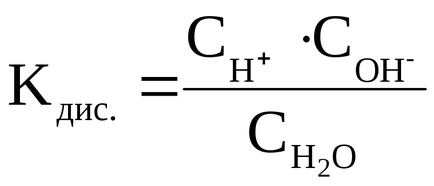
Перепишемо це рівняння:
Слід підкреслити, що дана формула містить рівноважні концентрації молекул Н2 О, іонів Н + і ОН -. які встановилися на момент настання рівноваги в реакції дисоціації Н2 О.
Але, оскільки ступінь дисоціації Н2 Про дуже мала, можна вважати, що концентрація недіссоціірованних молекул Н2 О в момент настання рівноваги практично дорівнює загальній початковій концентрації води, тобто 55,56 моль / дм 3 (1 дм 3 Н2 Про містить 1000 г Н2 Про або 1000. 18 ≈ 55,56 (молей). У розбавлених водних розчинах можна вважати, що концентрація Н2 Про буде такою ж. Тому, замінивши в рівнянні (42) твір двох постійних величин
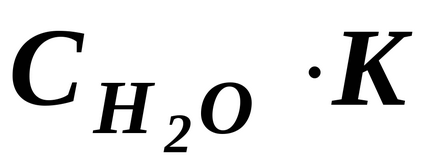
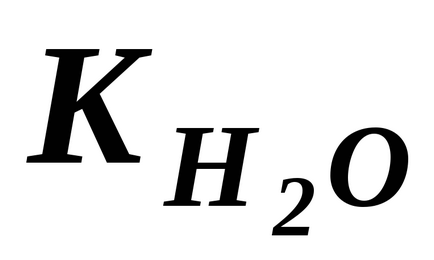
Отримане рівняння показує, що для води і розбавлених водних розчинів при незмінній температурі твір молярних концентрацій іонів водню і гідроксид-іонів є величина постійна. Вона називається інакше іонним твором води.
У чистій воді при 25 о С. Тому для зазначеної температури:
При збільшенні температури значенні
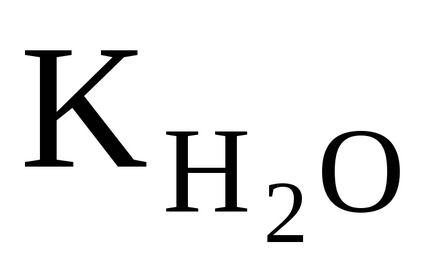
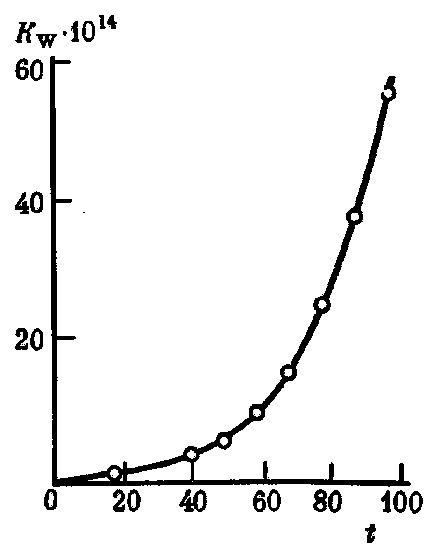
Мал. 34. Залежність константи дисоціації води Kw від температуриt (° С)
Розчини, в яких концентрації іонів Н + і ОН-однакові, називаютсянейтральнимі розчинами. Вкіслихрастворах більше міститься іонів водню, а вщелочних- гідроксид-іонів. Але якою б не була реакція середовища в розчині, твір молярних концентрацій іонів Н + і ОН - залишиться постійним.
Якщо, наприклад, до чистої Н2 Про додати кілька кислоти і концентрація іонів Н + при цьому збільшиться до 10 -4 моль / дм 3. то концентрація іонів ОН - відповідно знизиться так, що твір
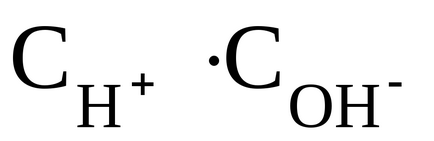
На практиці для кількісної характеристики кислотності або лужності розчину використовують не молярна концентрація в ньому іонів Н +. а її негативний десятковий логарифм. Ця величина називаетсяводородним показником і позначається черезрН:
Наприклад, якщо, то рН = 2; якщо, то рН = 10. У нейтральному розчині рН = 7. У кислих розчинах рН <7 (и тем меньше, чем «кислее» раствор, т.е. чем больше в нём концентрация ионов Н + ). В щёлочных растворах рН> 7 (і тим більше, ніж «лужні» розчин, тобто чим менше в ньому концентрація іонів Н +).
Для вимірювання рН розчину існують різні методи. Дуже зручно приблизно оцінювати реакцію розчину за допомогою спеціальних реактивів, званих кислотно-основними індикаторами. Забарвлення цих речовин в розчині змінюється в залежності від концентрації в ньому іонів Н +. Характеристика деяких найбільш поширених індикаторів представлена в таблиці 12.
Таблиця 12. Найважливіші кислотно-основні індикатори