Будова атомного ядра
Атом складається з ядра і навколишнього його електронного "хмари", тобто з електронної оболонки. Електронна оболонка атома - це сукупність елементарних частинок - електронів, кожному з яких властивий корпускулярно-хвильової характер.
Знаходяться в електронному хмарі електрони несуть негативний електричний заряд. Протони. що входять до складу ядра, несуть позитивний заряд.
У будь-якому атомі число протонів в ядрі в точності дорівнює числу електронів в електронному хмарі, тому атом в цілому - нейтральна частинка, що не несе заряду.
Атом може втратити один або кілька електронів або навпаки - захопити чужі електрони. У цьому випадку атом набуває позитивний чи негативний заряд і називається іоном.
Практично вся маса атома зосереджена в його ядрі, так як маса електрона складає всього лише 1/1836 частина маси протона. Щільність речовини в ядрі фантастично велика - близько 10 13 - 10 14 г / см 3. Сірниковий коробок, наповнений речовиною такої щільності, важив би 2,5 мільярда тонн!
Зовнішні розміри атома - це розміри набагато менш щільного електронного хмари, яке приблизно в 100000 разів більше діаметру ядра.
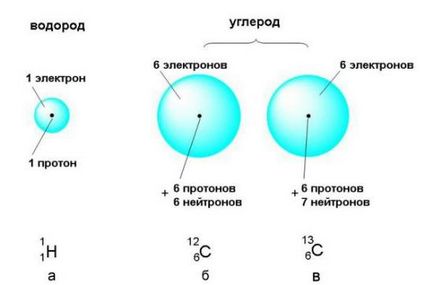
Крім протонів, до складу ядра більшості атомів входять нейтрони. не несуть ніякого заряду. Маса нейтрона практично не відрізняється від маси протона. Разом протони і нейтрони називаються нуклонами (від латинського nucleus - ядро).
Електрони, протони і нейтрони є головними "будівельними деталями" атомів і називаються субатомними частинками. Їх заряди і маси в кг і в спеціальних "атомних" одиницях маси (а.е.м.) показані в таблиці.
Таблиця. Субатомні частинки.
З таблиці видно, що маси субатомних частинок надзвичайно малі. Показник ступеня (наприклад, десять в мінус двадцять сьомий ступеня) показує, скільки нулів після коми потрібно записати, щоб вийшла десяткова дріб, якою виражено масу субатомной частки в кілограмах. Це незначна частина кілограма, тому масу субатомних частинок зручніше висловлювати в атомних одиницях маси (скорочено - а.е.м.). За атомну одиницю маси прийнята рівно 1/12 частина маси атома вуглецю, в ядрі якого міститься 6 протонів і 6 нейтронів. Схематичне зображення такого "еталонного" атома вуглецю наведено на рис. 2-5 (б). Атомну одиницю маси можна висловити і в грамах: 1 а.е.м. = 1,660540 · 10 -24 м
Маса атома, виражена в кілограмах або грамах, називається абсолютною атомною масою. Найчастіше користуються відносною атомною масою. яка виражається в атомних одиницях маси (а.е.м.). Відносна атомна маса являє собою відношення маси якого-небудь атома до маси 1/12 частини атома вуглецю. Іноді говорять більш коротко: атомний вагу.
В українських підручниках користуються терміном відносна атомна маса. яку позначають символом Ar. Тут "r" - від англійського "relative" - відносний. Наприклад, Ar = 12,0000 - відносна атомна маса вуглецю 12С 6 C дорівнює 12,0000.