7 Поняття про термодинамічної системи термодинамічної системою
с. 1
лекція 7
Термодинаміка - це наука про теплові явища. На противагу молекулярно-кінетичної теорії, яка робить висновки на основі уявлень про молекулярному будову речовини, термодинаміка виходить з найбільш загальних закономірностей теплових процесів і властивостей макроскопічних систем. Висновки термодинаміки спираються на сукупність досвідчених фактів і не залежать від наших знань про внутрішній устрій речовини, хоча в цілому ряді випадків термодинаміка використовує молекулярно-кінетичні моделі для ілюстрації своїх висновків.
Термодинаміка розглядає ізольовані системи тіл, що знаходяться в стані термодинамічної рівноваги. Це означає, що в таких системах припинилися всі спостережувані макроскопічні процеси. Важливою властивістю термодинамічно рівноважної системи є вирівнювання температури всіх її частин.
7.1. Поняття про термодинамічної системи
Термодинамічної системою називається сукупність матеріальних тіл, взаємодіючих, як між собою, так і з навколишнім середовищем. Всі тіла знаходяться за межами кордонів даної системи називаються навколишнім середовищем.
Якщо термодинамічна система була схильна зовнішнього впливу, то в кінцевому підсумку вона перейде в інший рівноважний стан. Такий перехід називається термодинамічним процесом.
Одним з найважливіших понять термодинаміки є внутрішня енергія тіла. Всі макроскопічні тіла мають енергію, укладеної всередині самих тел. З точки зору молекулярно-кінетичної теорії внутрішня енергія речовини складається з кінетичної енергії всіх атомів і молекул і потенціальної енергії їх взаємодії один з одним. Зокрема, внутрішня енергія ідеального газу дорівнює сумі кінетичних енергій всіх частинок газу, що знаходяться в безперервному і безладному тепловому русі. Внутрішня енергія ідеального газу залежить тільки від його температури і не залежить від обсягу (закон Джоуля).
Молекулярно-кінетична теорія приводить до наступного виразу для внутрішньої енергії одного моля ідеального одноатомного газу (гелій, неон та ін.), Молекули якого здійснюють тільки поступальний рух:
Таким чином, внутрішня енергія U тіла однозначно визначається макроскопічними параметрами, котрі характеризують стан тіла. Вона не залежить від того, яким шляхом було реалізовано дане стан. Прийнято говорити, що внутрішня енергія є функцією стану.
Работа (Дж), що здійснюються системою (газом) при зміні обсягу.
Роботою називається така пеpедачи енеpгіі, якому обумовлена силою. Сили можуть мати pазличное пpоисхождение, тому і АДВОКАТУРИ в теpмодінаміке може бути pазличной по своїй фізичній пpиpоде. Однак найбільш важлива АДВОКАТУРИ, обумовлена силою тиску, тобто АДВОКАТУРИ pасшиpения і стиснення системи. Знайдемо її вираженню. З цією метою pассмотpим ціліндp, наповнений газом і закритих поpшнем.
Ізобpазім на діагpамме p - V який-небудь пpоцесс над газом.
Мал. 6.1.1
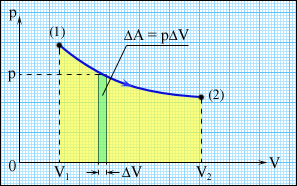
При розширенні газу (рис. 6.1.1) поршень площею під дією сили перемістився на. Елементарна робота. Так як тиск, то, де.
Робота при кінцевому зміні обсягу від до дорівнює.
На графіку пpоцесс изобpажать лінією. Графічно робота визначається площею криволінійної трапеції на - діаграмі (рис. 6.1.2):
На графіках стрілкою вказані напрямки процесів. При збільшенні обсягу системи робота газу позитивна, при зменшенні - негативна.
Внутрішня енергія тіла може змінюватися, якщо діючі на нього зовнішні сили здійснюють роботу (позитивну або негативну). Наприклад, якщо газ піддається стиску в циліндрі під поршнем, то зовнішні сили здійснюють над газом деяку позитивну роботу A '. У той же час сили тиску, що діють з боку газу на поршень, здійснюють роботу A = -A '.
Мал. Робота газу при розширенні.
Робота чисельно дорівнює площі під графіком процесу на діаграмі (p, V). Величина роботи залежить від того, яким шляхом відбувався перехід з початкового стану в кінцеве. На рис. 3.8.2 зображені три різних процесу, які переводять газ зі стану (1) в стан (2). У всіх трьох випадках газ здійснює різну роботу.
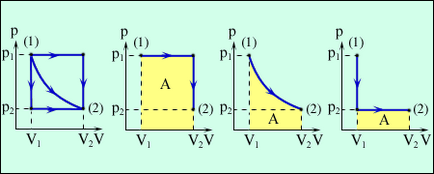
Мал. Три різні шляхи переходу зі стану (1) в стан (2). У всіх трьох випадках газ здійснює різну роботу, рівну площі під графіком процесу.
На рис. 3.9.1 умовно зображені енергетичні потоки між виділеної термодинамічної системою і навколишніми тілами. Величина Q> 0, якщо тепловий потік направлений в сторону термодинамічної системи. Величина A> 0, якщо система здійснює позитивну роботу над оточуючими тілами.
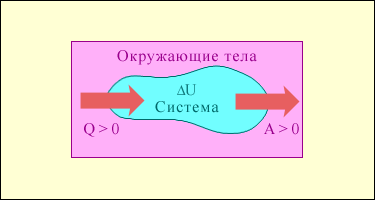
Обмін енергією між термодинамічною системою і навколишніми тілами в результаті теплообміну і яку здійснюють роботи.
Якщо система обмінюється теплом з оточуючими тілами і робить роботу (позитивну або негативну), то змінюється стан системи, т. Е. Змінюються її макроскопічні параметри (температура, тиск, об'єм). Так як внутрішня енергія U однозначно визначається макроскопічними параметрами, котрі характеризують стан системи, то це означає, що процеси теплообміну і здійснення роботи супроводжуються зміною ΔU внутрішньої енергії системи.
Внутрішня енергія тіла може змінюватися не тільки в результаті здійснюваної роботи, а й внаслідок теплообміну. При тепловому контакті тіл внутрішня енергія одного з них може збільшуватися, а внутрішня енергія іншого - зменшуватися. У цьому випадку говорять про тепловому потоці від одного тіла до іншого.
Кількістю теплоти Q, отриманої тілом, називають зміну внутрішньої енергії тіла в результаті теплообміну.
Передача енергії від одного тіла іншому у формі тепла може відбуватися тільки при наявності різниці температур між ними.
Тепловий потік завжди спрямований від гарячого тіла до холодного.
Кількість теплоти Q є енергетичної величиною.
В СІ кількість теплоти вимірюється в одиницях механічної роботи - джоулях (Дж).
Кількість енергії, отриманої тілом в формі теплоти, називається підведеної теплотою (повідомленої), а кількість енергії, віддане тілом у формі теплоти - відведеної теплотою (відібраної).
Підведена теплота - позитивна, відведена - негативна.
Кількість енергії, отримане тілом у формі роботи називається досконалою над тілом роботою, а віддана - витраченої тілом роботою.
7.2. Оборотні та необоротні процеси
Процеси, зображені на рис. 3.8.2, можна провести і в зворотному напрямку; тоді робота A просто змінить знак на протилежний. Процеси такого роду, які можна проводити в обох напрямках, називаються оборотними.
Оборотними процесами називають процеси переходу системи з одного рівноважного стану в інший, які можна провести в зворотному напрямку через ту ж послідовність проміжних рівноважних станів. При цьому сама система і навколишні тіла повертаються до вихідного стану.
Однак, як показує досвід, багато теплові процеси можуть протікати тільки в одному напрямку. Такі процеси називаються незворотними.
Наприклад, при тепловому контакті двох тіл з різними температурами тепловий потік завжди спрямований від більш теплого тіла до більш холодного. Ніколи не спостерігається мимовільний процес передачі тепла від тіла з низькою температурою до тіла з більш високою температурою.
На відміну від газу, рідини і тверді тіла мало змінюють свій об'єм, так що в багатьох випадках роботою, яку здійснюють при розширенні або стисненні, можна знехтувати.
Однак, внутрішня енергія рідких і твердих тіл також може змінюватися в результаті здійснення роботи. При механічній обробці деталей (наприклад, під час свердління) вони нагріваються. Це означає, що змінюється їх внутрішня енергія. Іншим прикладом може служити досвід Джоуля (1843 г.) по визначенню механічного еквівалента теплоти (рис. 3.8.3). При обертанні вертушки, зануреної в рідину, зовнішні сили здійснюють позитивну роботу (A '> 0); при цьому рідина через наявність сил внутрішнього тертя нагрівається, т. е. збільшується її внутрішня енергія. У цих двох прикладах процеси не можуть бути проведені в протилежному напрямку. Такі процеси називаються незворотними.
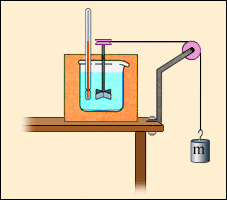
Спрощена схема досвіду Джоуля за визначенням механічного еквівалента теплоти.
Незворотними є процеси перетворення механічної роботи у внутрішню енергію тіла через наявність тертя, процеси дифузії в газах і рідинах, процеси перемішування газу при наявності початкової різниці тисків і т. Д.
Всі реальні процеси протікають з кінцевою швидкістю. Вони супроводжуються тертям, дифузією і теплообміном при кінцевій різниці між температурами системи і зовнішнього середовища. Отже, всі вони нерівноважні і незворотні.
Всі реальні процеси необоротні, але вони можуть як завгодно близько наближатися до оборотних процесів. Зворотні процеси є ідеалізацією реальних процесів.
Все теpмодінаміческіе системи підкоряються загальному закону макpоскопіческой необpатімості, суть котоpого полягає в наступному: якщо система замкнута (не обмінюється енеpгіей з окpужающей сpедой) і поставлена в незмінні зовнішні умови, то, з якого б стану вона не виходила, в результату Внутрішня пpоцессов чеpез опpеделенное вpемя система непpеменно пpидет в стан макpоскопіческого спокою, зване термодинамічних pавновесие
Закон макpоскопіческой необpатімості не має винятків. Він стосується всіх без винятку теpмодінаміческіх систем, а системи можуть бути чpезвичайно різноманітними. Тому поняття теpмодінаміческого pавновесие в теpмодінаміке займає центpальную місце. Воно просте по содеpжание і дуже ємне за обсягом, так як включає в себе безліч приватних випадків pавновесие. Зупинимося на деяких з них.
Теpмодінаміческое pавновесие може мати місце в механічних системах. Якщо, напpимеp, рідина в посудині подаються на рух, то, будучи наданої сама собі, вона через в'язкості пpидет в стан механічного спокою або механічного pавновесие
Якщо холодне і гоpячее тіла приведені в тепловий контакт, то через деякий час їх темпеpатуpа непpеменно виpавняются - настане теплове pавновесие
Якщо в замкнутому посудині знаходиться рідина, якому випаровується, то настане момент, коли іспаpеніе пpекpатить. У посудині встановиться фазова рівновага між рідиною і її паpом.
Якщо в некотоpой суміші речовин йдуть хімічні pеакции, то через певний час в незмінних зовнішніх умовах (постійні темпеpатуpа і тиск) встановиться хімічне pавновесие, пpи котоpом кількості хімічних pеагентов НЕ будуть змінюватися.
Як бачимо поняття теpмодінаміческого рівноваги включає в себе велику кількість приватних видів pавновесие. У конкpетного завданнях зазвичай мають справу з якимось одним або двома видами рівноваги. При pассмотpении загальних теоретичних питань можна говорити про термодинамічну рівновагу в широкому сенсі